Оксид марганца (MnO2) Химическая структура, свойства и применение
оксид марганца (MnO2) представляет собой неорганическое химическое соединение, образованное элементом марганец с степенью окисления +4 и кислородом, которое при образовании оксидов имеет степень окисления -2. Он также известен под названиями оксида марганца (IV) и ангидрида марганца..
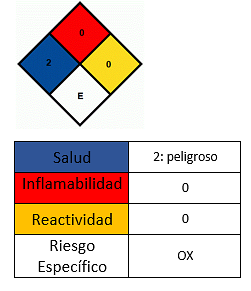
Это твердое вещество от темного до черного кофе. Он в природе как минерал пиролузит, черный и кристаллизуется, образуя дендриты (разветвленные удлинения). Его можно получить в виде черного остатка в реакции между этиленом и перманганатом калия после образования гликоля в результате окислительного действия перманганата калия..

Это очень важно в стекольной промышленности из-за его характера окислителя, так как он устраняет зеленый цвет, исходящий от соединений железа, и превращает их в железо..
индекс
- 1 Химическая структура
- 2 свойства
- 3 использования
- 3.1 В качестве катализатора
- 4 Влияние на здоровье
- 5 ссылок
Химическая структура
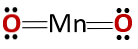
Химическая структура соединения соответствует структуре ангидрида, а не основного оксида, как и следовало ожидать, поскольку оно состоит из металла и неметалла..
Этот особый случай обусловлен поведением марганца в различных состояниях окисления, которые он имеет. Таким образом, для состояний окисления +2 и +3 образуются оксиды MnO и Mn2О3 соответственно, что при взаимодействии с водой они образуют гидроксид марганца и гидроксид марганца, соответственно.
Тем не менее, Mn2О3 в слабокислой среде он ведет себя как ангидрид. При степени окисления +4, +6 и +7, MnO2, МНО3 и MnO4 они образуют кислоты при реакции с водой.
В слабокислой среде MnO2 он ведет себя как основной оксид, поэтому может образовывать соответствующий гидроксид.

Следует иметь в виду, что в этом случае нет упоминания об амфотерных свойствах, согласно которым соединение может вести себя как кислота или основание. Это частный случай поведения Mn.
свойства
приложений
- Используется в качестве источника марганца
- В качестве окислителя в щелочных батареях
- Краски для стекла, керамики и фарфора.
- При получении хлора и йода.
- При разложении перекиси водорода для образования газообразного кислорода и воды.
- В реакции разложения хлората калия для производства газообразного кислорода и хлорида калия.
- Растворяется в ацетоне или дихлорметане, окисляет первичные спирты до альдегидов и вторично по отношению к кетонам.
- Производство щелочных батарей.
В качестве катализатора
Это относится к реакциям восстановления оксидов, для удаления сульфидов, таких как H2S и катионы, такие как Fe+2 и Mn+2 , Мышьяк и радио найдены в подземных водах, которые загрязнены этим типом соединений.
Это загрязнение может быть вызвано неконтролируемым сбросом токсичных материалов, промывкой загрязненной почвы или присутствием химических элементов во время извлечения воды..
МНО2 Высокая чистота, полученная из пиролузита, используемого в качестве фильтра (Filox), является наиболее эффективным средством для удаления этого класса примесей из подземных вод..
Влияние на здоровье
- Избегать контакта с кожей.
- В случае контакта помойте соответствующую зону.
- Не вдыхать порошки.
- Раздражение и покраснение можно увидеть при попадании в глаза. Промойте большим количеством воды, дайте воде протечь через глаза и в случае серьезного вызова обратитесь за медицинской помощью..
- При попадании на кожу наблюдается раздражение и покраснение. Промойте пораженный участок большим количеством воды и мыла.
- Длительный контакт с кожей удаляет ваш естественный жир, вызывая дерматит.
- Вдыхание может вызвать гриппоподобное состояние (металлические пары). Состояние характеризуется высокой температурой, ознобом, сухостью во рту и горле, мышечной болью и головной болью.
- Это может раздражать дыхательные пути и увеличивать частоту респираторных инфекций (пневмония). Интоксикация при абсорбции неорганических солей марганца через легкие маловероятна, но может возникнуть хроническое отравление.
- Хроническое воздействие пыли или паров двуокиси марганца в течение длительного периода может повлиять на центральную нервную систему и привести к развитию болезни Паркинсона, затруднений при ходьбе, мышечных спазмов и изменений в поведении..
- Проглатывание может вызвать боль в животе и тошноту.
- Это не огнеопасно, но это помогает распространить огонь в раскаленных материалах. При нагревании до температуры выше 535 ° С вещество разлагается до оксида марганца (III) Mn2О3 и кислород, который является легковоспламеняющимся и увеличивает опасность возгорания. В этом случае пожар следует потушить пеной или углекислым газом..
- В случае утечки, не манипулируйте составом без надлежащей личной защиты.
- Храните состав в плотно закрытых контейнерах, в холодном и сухом месте, вдали от несовместимых веществ, таких как органический материал и горючий материал..
- Место хранения должно быть сухим и иметь полы, устойчивые к кислотной коррозии и с хорошим дренажом..
- Следует использовать средства индивидуальной защиты, такие как перчатки, защитные очки, маски против паровых фильтров, пыль и дым.
ссылки
- B, (2015), двуокись марганца, Королевское химическое общество - мир химии, получено с chemworld.com
- Karal, (2014), двуокись Мангнесо, паспорт безопасности, восстановлено с, karal.com.mx
- Ваш виртуальный учитель (2/25/2015). Марганцевые неорганические соединения (особый случай 1) - теоретический урок), взято с сайта youtube.com
- Ecured, (s.f), двуокись марганца, восстановлена из ecured.cu
- Angarita G, Johnny., (2017), диоксид марганца: исключительная технология. Hidroteco, восстановлено от hydrotecocr.com
- Фернандес, Г., (2015), MnO диоксид марганца2/ ацетон, Органическая химия, Восстановлено с quimicaorganica.net
- Tronox, (2011), диоксид марганца, паспорт безопасности, восстановлено, tronox.com


