Типы кетонов, свойства, номенклатура, использование и примеры
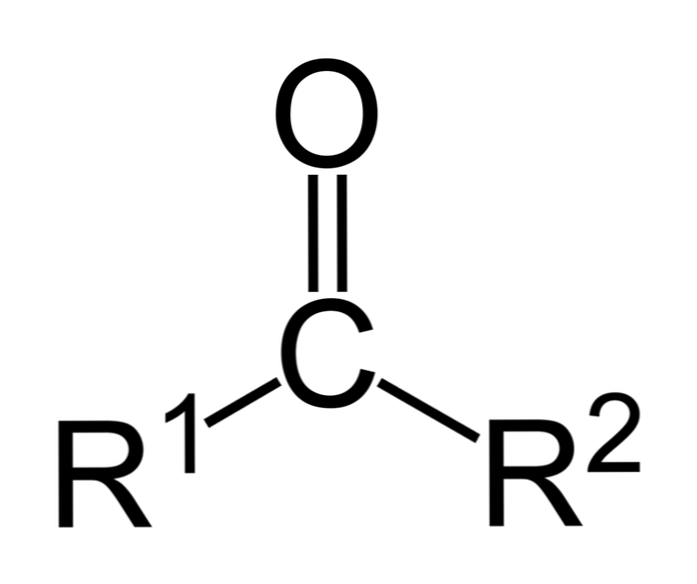
кетонов это органические соединения, которые имеют карбонильную группу (-СО). Это простые соединения, в которых углерод карбонильной группы связан с двумя атомами углерода (и их заместителями). Кетоны являются «простыми», потому что они не имеют реакционноспособных групп, таких как -ОН или -Cl, связанных с углеродом..
Наконец, выведение кетонов из организма человека обычно связано с низким уровнем сахара (в случаях диабета и / или чрезмерного голодания), что может вызвать серьезные проблемы со здоровьем у пациента.
индекс
- 1 Общая формула кетонов
- 2 типа кетонов
- 2.1 Согласно структуре вашей сети
- 2.2 По симметрии его радикалов
- 2.3 По насыщенности его радикалами
- 2.4 Дицетоны
- 3 Физико-химические свойства кетонов
- 3.1 Точка кипения
- 3.2 Растворимость
- 3.3 Кислотность
- 3.4 Реакционная способность
- 4 Номенклатура
- 5 Разница между альдегидами и кетонами
- 6 Промышленное и повседневное использование
- 7 примеров кетонов
- 7,1 бутанон (C4H8O)
- 7,2 циклогексанона (C6H10O)
- 7.3 Тестостерон (C19H22O2)
- 7,4 Прогестерон (C21H30O2)
- 8 ссылок
Общая формула кетонов
Кетоны представляют собой карбонильные соединения, в которых эта группа связана с двумя углеводородными группами; это могут быть алкильные группы, бензольные кольцевые группы или оба.
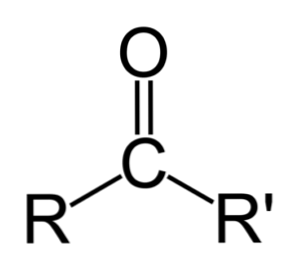
Кетон может быть просто представлен как R- (C = O) -R ', где R и R' представляют собой любые две углеводородные цепи (алканы, алкены, алкины, циклоалканы, производные бензола и другие). Там нет кетонов с водородом, присоединенным к карбонильной группе.
Существует множество методов получения кетонов в промышленных и лабораторных условиях; Кроме того, важно отметить, что кетоны могут синтезироваться различными организмами, включая человека.
В промышленности наиболее распространенный метод синтеза кетонов включает окисление углеводородов, как правило, с использованием воздуха. В небольших масштабах кетоны обычно получают путем окисления вторичных спиртов, что дает в качестве продуктов кетон и воду..
Помимо этих наиболее распространенных методов, кетоны можно синтезировать с помощью алкенов, алкинов, солей азотных соединений, сложных эфиров и многих других соединений, что облегчает их получение..
Типы кетонов
Существует несколько классификаций кетонов, зависящих в основном от заместителей в их цепях R. Ниже приведены наиболее распространенные классификации для этих веществ:
По структуре вашей сети
В этом случае кетон классифицируется по способу структурирования его цепи: алифатическими кетонами являются те, которые имеют два радикала R и R ', которые имеют форму алкильных радикалов (алканы, алкены, алкины и циклоалканы).
Со своей стороны, ароматические соединения - это те, которые образуют производные бензола, оставаясь при этом кетонами. Наконец, смешанные кетоны - это те, которые имеют R алкильный радикал и R 'арильный радикал или наоборот.
По симметрии его радикалов
В этом случае изучаются радикалы R и R 'заместителей карбонильной группы; когда они равны (идентичны), кетон называется симметричным; но когда они разные (как и большинство кетонов), это называется асимметричным.
По насыщенности его радикалами
Кетоны также могут быть классифицированы в соответствии с насыщенностью их углеродных цепей; Если они находятся в форме алканов, кетон называется насыщенным кетоном. Напротив, если цепочки находятся в виде алкенов или алкинов, кетон называется ненасыщенным кетоном..
дикетонов
Это отдельный класс кетонов, так как цепи этого кетона имеют две карбонильные группы в своей структуре. Некоторые из этих кетонов имеют уникальные характеристики, такие как более длинная длина связи между атомами углерода.
Например, дикетоны, полученные из циклогексана, известны как хиноны, которых всего два: орто-бензохинон и пара-бензохинон.
Физико-химические свойства кетонов
Кетоны, как и большинство альдегидов, представляют собой жидкие молекулы и обладают рядом физических и химических свойств, которые варьируются в зависимости от длины их цепей. Его свойства описаны ниже:
Точка кипения
Кетоны обладают высокой летучестью, высокой полярностью и не могут отдавать водороды для водородных связей (они не имеют атомов водорода, связанных с их карбонильной группой), поэтому они имеют более высокие точки кипения, чем алкены и простые эфиры, но ниже, чем те спирты с одинаковой молекулярной массой.
Температура кипения кетона увеличивается с увеличением размера молекулы. Это связано с вмешательством ван-дер-ваальсовых сил и диполь-дипольных сил, которые требуют большего количества энергии для разделения атомов и электронов, привлеченных к молекуле..
растворимость
Растворимость кетонов оказывает сильное влияние частично на способность этих молекул принимать водород в своем атоме кислорода и, таким образом, образовывать водородную связь с водой. Кроме того, между кетонами и водой образуются притягивающие, рассеивающие и диполь-дипольные силы, которые усиливают их растворимый эффект..
Кетоны теряют растворимость по мере увеличения их молекулы, так как они начинают требовать больше энергии для растворения в воде. Они также растворимы в органических соединениях.
кислотность
Благодаря своей карбонильной группе кетоны имеют кислотную природу; это происходит из-за резонансной стабилизационной способности этой функциональной группы, которая может переносить протоны из своей двойной связи с образованием сопряженного основания, называемого енолом.
реактивность
Кетоны являются частью большого количества органических реакций; это происходит из-за чувствительности его карбонильного углерода к нуклеофильному присоединению, в дополнение к полярности этого.
Как указано выше, высокая реакционная способность кетонов делает их признанным промежуточным продуктом, который служит основой для синтеза других соединений..
номенклатура
Кетоны названы в соответствии с приоритетом или важностью карбонильной группы во всей молекуле, поэтому, когда у вас есть молекула, управляемая карбонильной группой, кетон назван путем добавления суффикса "-one" к названию углеводорода..
Самая длинная цепь с карбонильной группой берется в качестве главной цепи, а затем молекула называется. Если карбонильная группа не имеет приоритета над другими функциональными группами молекулы, то она идентифицируется как "-oxo".
Для более сложных кетонов положение функциональной группы может быть идентифицировано числом, а в случае дикетонов (кетонов с двумя одинаковыми заместителями R и R ') указывается молекула с суффиксом "-дион"..
Наконец, слово «кетон» также можно использовать после идентификации цепей радикалов, связанных с карбонильной функциональной группой..
Разница между альдегидами и кетонами
Самое большое различие между альдегидами и кетонами заключается в наличии атома водорода, присоединенного к карбонильной группе в альдегидах.
Этот атом оказывает важное влияние, когда речь идет о вовлечении молекулы в реакцию окисления: альдегид образует карбоновую кислоту или соль карбоновой кислоты, в зависимости от того, происходит ли окисление в кислотных или основных условиях..
Напротив, кетон не имеет этого водорода, поэтому минимальные шаги, необходимые для окисления, не происходят.
Существуют методы окисления кетона (с окислителями, намного более сильными, чем обычно используемые), но они разбивают молекулу кетона, разделяя ее сначала на две или более частей..
Промышленное и повседневное использование
В промышленности кетоны часто встречаются в парфюмерии и красках, выполняя роль стабилизаторов и консервантов, которые препятствуют разложению других компонентов смеси; они также имеют широкий спектр применения в качестве растворителей в тех отраслях, которые производят взрывчатые вещества, краски и текстиль в дополнение к фармацевтическим препаратам..
Ацетон (самый маленький и самый простой кетон) является растворителем, признанным во всем мире, и используется в качестве растворителя и растворителя..
В природе кетоны могут появляться в виде сахаров, называемых кетозами. Кетозы - это моносахариды, которые содержат один кетон на молекулу. Самая известная кетоза - фруктоза, сахар, содержащийся во фруктах и меде..
Биосинтез жирных кислот, который происходит в цитоплазме клеток животных, также происходит под действием кетонов. Наконец, как уже упоминалось выше, может наблюдаться повышение кетонов в крови после голодания или в случаях диабета..
Примеры кетонов
Бутанон (C4H8O)
Также известная как MEK (или MEC), эта жидкость производится в промышленных масштабах и используется в качестве растворителя..
Циклогексанон (С6H10O)
Произведенный в больших масштабах, этот кетон используется в качестве предшественника синтетического нейлонового материала..
Тестостерон (С19H22О2)
Это основной гормон мужского пола и анаболический стероид, встречающийся у большинства позвоночных..
Прогестерон (С21H30О2)
Эндогенные стероиды и половые гормоны, участвующие в менструальном цикле, беременности и эмбриогенезе у людей и других видов.
ссылки
- Wikipedia. (Н.Д.). Кетоны. Получено с en.wikipedia.org
- Britannica, E. (s.f.). Кетоны. Получено с сайта britannica.com
- Университет, М. С. (с.ф.). Альдегиды и кетоны. Извлечено из химии.msu.edu
- ChemGuide. (Н.Д.). Представляем альдегиды и кетоны. Получено с chemguide.co.uk
- Калгари, США (с.ф.). Кетоны. Получено с сайта chem.ucalgary.ca


