Кетогенез, типы кетоновых тел, синтез и деградация
cetogénesis это процесс, с помощью которого получают ацетоацетат, β-гидроксибутират и ацетон, которые вместе называют кетоновыми телами. Этот сложный и тонко регулируемый механизм осуществляется в митохондриях, от катаболизма жирных кислот.
Получение кетоновых тел происходит, когда организм подвергается истощающим периодам голодания. Хотя эти метаболиты синтезируются в основном в клетках печени, они обнаруживаются в качестве важного источника энергии в различных тканях, таких как скелетные мышцы и ткани сердца и головного мозга..
Hydro-гидроксибутират и ацетоацетат являются метаболитами, используемыми в качестве субстратов в сердечной мышце и коре почек. В мозгу кетоновые тела становятся важными источниками энергии, когда организм исчерпал свой запас глюкозы.
индекс
- 1 Общая характеристика
- 2 Типы и свойства кетоновых тел
- 3 Синтез кетоновых тел
- 3.1 Условия для кетогенеза
- 3.2 Механизм
- 3.3 β-окисление и кетогенез связаны между собой
- 3.4 Регуляция β-окисления и его влияние на кетогенез
- 4 Деградация
- 5 Медицинская значимость кетоновых тел
- 5.1 Сахарный диабет и накопление кетоновых тел
- 6 Ссылки
Общие характеристики
Кетогенез считается очень важной физиологической функцией или метаболическим путем. Как правило, этот механизм осуществляется в печени, хотя было показано, что он может осуществляться в других тканях, способных метаболизировать жирные кислоты..
Образование кетоновых тел является основным метаболическим производным ацетил-КоА. Этот метаболит получают из метаболического пути, известного как β-окисление, которое является разложением жирных кислот.
Наличие глюкозы в тканях, где происходит β-окисление, определяет метаболическую судьбу ацетил-КоА. В особых ситуациях окисленные жирные кислоты почти полностью направляются на синтез кетоновых тел..
Типы и свойства кетоновых тел
Основным кетоновым телом является ацетоацетат или ацетоуксусная кислота, которая синтезируется главным образом в клетках печени. Другие молекулы, которые составляют кетоновые тела, происходят из ацетоацетата.
Восстановление ацетоуксусной кислоты приводит к образованию D-β-гидроксибутирата, второго кетонового тела. Ацетон представляет собой соединение, которое трудно разлагать, и он образуется в результате спонтанной реакции декарбоксилирования ацетоацетата (поэтому он не требует вмешательства какого-либо фермента), когда он присутствует в высоких концентрациях в крови.
Обозначение кетоновых тел было принято условно, поскольку, строго говоря, β-гидроксибутират не имеет кетонной функции. Эти три молекулы растворимы в воде, что облегчает их транспорт в крови. Его основная функция заключается в обеспечении энергией определенных тканей, таких как скелетные и сердечные мышцы..
Ферменты, участвующие в образовании кетоновых тел, в основном находятся в клетках печени и почек, что объясняет, почему эти два места являются основными продуцентами этих метаболитов. Его синтез происходит только и исключительно в митохондриальном матриксе клеток..
Как только эти молекулы синтезируются, они попадают в кровоток и попадают в ткани, которые в них нуждаются, где они разлагаются до ацетил-КоА..
Синтез кетоновых тел
Условия для кетогенеза
Метаболическая судьба ацетил-КоА от β-окисления зависит от метаболических потребностей организма. Это окисляется до СО2 и H2Или через цикл лимонной кислоты или синтез жирных кислот, если метаболизм липидов и углеводов в организме стабилен.
Когда организму требуется образование углеводов, оксалоацетат используется для производства глюкозы (глюконеогенез) вместо запуска цикла лимонной кислоты. Это происходит, как уже упоминалось, когда организм имеет некоторую неспособность получить глюкозу в таких случаях, как длительное голодание или наличие диабета..
В связи с этим ацетил-КоА, полученный в результате окисления жирных кислот, используется для производства кетоновых тел..
механизм
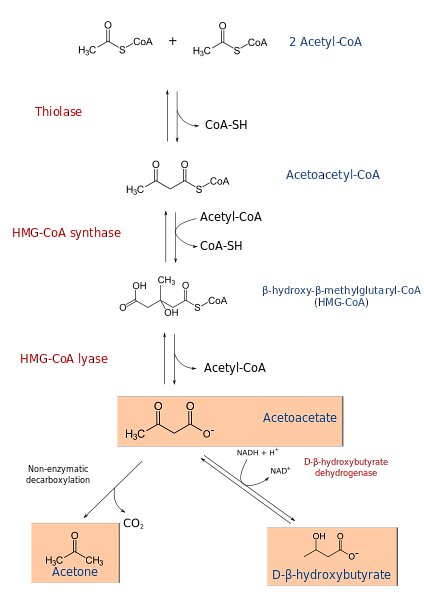
Процесс кетогенеза начинается с продуктов β-окисления: ацетацетил-КоА или ацетил-КоА. Когда субстратом является ацетил-КоА, на первом этапе происходит конденсация двух молекул, реакция, катализируемая ацетил-КоА-трансферазой, с образованием ацетацетил-КоА.
Ацетацетил-КоА конденсируется с третьим ацетил-КоА под действием синтазы ГМГ-КоА с образованием ГМГ-КоА (β-гидрокси-β-метилглутарил-КоА). HMG-CoA разлагается до ацетоацетата и ацетил-КоА под действием лиазы HMG-CoA. Таким образом получается первое кетоновое тело..
Ацетоацетат восстанавливается до β-гидроксибутирата путем вмешательства β-гидроксибутиратдегидрогеназы. Эта реакция зависит от НАДН.
Основным ацетоацетатным кетоновым телом является β-кетокислота, которая подвергается неферментативному декарбоксилированию. Этот процесс прост и производит ацетон и СО2.
Таким образом, эта серия реакций приводит к образованию кетоновых тел. Они, будучи растворимыми в воде, могут легко транспортироваться через кровоток без необходимости прикрепления к структуре альбумина, как в случае жирных кислот, которые нерастворимы в водной среде..
Β-окисление и кетогенез связаны между собой
Метаболизм жирных кислот производит субстраты для кетогенеза, поэтому эти два пути функционально связаны.
Ацетоацетил-КоА является ингибитором метаболизма жирных кислот, поскольку он останавливает активность ацил-КоА-дегидрогеназы, которая является первым ферментом β-окисления. Кроме того, он также оказывает ингибирование на ацетил-КоА-трансферазу и синтазу HMG-КоА..
Фермент синтаза HMG-CoA, подчиненный СРТ-I (фермент, участвующий в производстве ацилкарнитина при β-окислении), представляет важную регуляторную роль в образовании жирных кислот.
Регуляция β-окисления и его влияние на кетогенез
Питание организмов регулирует сложный набор гормональных сигналов. Углеводы, аминокислоты и липиды, потребляемые в рационе, откладываются в форме триацилглицеринов в жировой ткани. Инсулин, анаболический гормон, участвует в синтезе липидов и образовании триацилглицеринов.
На уровне митохондрий β-окисление контролируется поступлением и участием некоторых субстратов в митохондриях. Фермент CPT I синтезирует ацилкарнитин из цитозольного ацил-КоА.
Когда организм питается, активируется ацетил-КоА-карбоксилаза, и цитрат повышает уровень СРТ I, а его фосфорилирование уменьшается (циклическая АМФ-зависимая реакция).
Это вызывает накопление малонил-КоА, который стимулирует синтез жирных кислот и блокирует их окисление, предотвращая образование бесполезного цикла..
В случае голодания активность карбоксилазы очень низка, так как уровни фермента СРТ I были снижены, и он был фосфорилирован, активируя и стимулируя окисление липидов, что впоследствии позволит образованию кетоновых тел через ацетил-КоА.
деградация
Кетоновые тела диффундируют из клеток, где они синтезируются и транспортируются кровью в периферические ткани. В этих тканях они могут окисляться через цикл трикарбоновых кислот.
В периферических тканях β-гидроксибутират окисляется до ацетоацетата. Впоследствии настоящий ацетоацетат активируется ферментом 3-кетоацил-КоА-трансферазой.
Сукцинил-КоА действует как донор КоА, становясь сукцинатом. Активация ацетоацетата происходит, чтобы предотвратить превращение сукцинил-КоА в сукцинат в цикле лимонной кислоты при сопряженном синтезе ГТФ под действием сукцинил-КоА-синтазы..
Полученный ацетоацетил-КоА подвергается тиолитическому расщеплению с образованием двух молекул ацетил-КоА, которые включаются в цикл трикарбоновых кислот, более известный как цикл Кребса..
В клетках печени отсутствует 3-кетоацил-КоА-трансфераза, предотвращающая активацию этого метаболита в этих клетках. Таким образом, гарантируется, что кетоновые тела не окисляются в клетках, где они были произведены, но что они могут переноситься в ткани, где требуется их активность..
Медицинская значимость кетоновых тел
В организме человека высокие концентрации кетоновых тел в крови могут вызывать особые состояния, называемые ацидозом и кетонемией..
Производство этих метаболитов соответствует катаболизму жирных кислот и углеводов. Одной из наиболее распространенных причин патологического состояния кетогенеза является высокая концентрация фрагментов дикарбоната уксусной кислоты, которые не разлагаются путем окисления трикарбоновых кислот..
Вследствие этого наблюдается повышение уровня кетоновых тел в крови выше 2-4 мг / 100 Н и их присутствие в моче. Это приводит к нарушению промежуточного метаболизма указанных метаболитов..
Определенные дефекты нейрогландулярных факторов гипофиза, которые регулируют деградацию и синтез кетоновых тел, наряду с нарушениями метаболизма углеводородов, являются причиной состояния гиперцетонемии..
Сахарный диабет и накопление кетоновых тел
Сахарный диабет (тип 1) является эндокринным заболеванием, вызывающим увеличение выработки кетоновых тел. Недостаточное производство инсулина препятствует транспорту глюкозы в мышцы, печень и жировую ткань, накапливаясь в крови.
Клетки в отсутствие глюкозы начинают процесс глюконеогенеза и распада жиров и белков для восстановления их метаболизма. Как следствие, концентрация оксалоацетата снижается, а окисление липидов увеличивается..
Затем происходит накопление ацетил-КоА, которое в отсутствие оксалоацетата не может следовать по пути лимонной кислоты, вызывая высокую выработку кетоновых тел, характерных для этого заболевания..
Накопление ацетона определяется его присутствием в моче и дыхании людей, которые имеют это состояние, и на самом деле является одним из симптомов, которые указывают на проявление этого заболевания.
ссылки
- Бласкес Ортиз, C. (2004). Кетогенез в астроцитах: характеристика, регуляция и возможная цитопротекторная роль (Докторская диссертация, Университет Мадрид, Издательская служба).
- Девлин Т. М. (1992). Учебник биохимии: с клиническими соотношениями.
- Garrett, R. H. & Grisham, C.M. (2008). биохимия. Томсон Брукс / Коул.
- McGarry, J.D., Mannaerts, G.P. & Foster, D.W. (1977). Возможная роль малонил-КоА в регуляции окисления жирных кислот в печени и кетогенеза. Журнал клинических исследований, 60(1), 265-270.
- Мело В., Руис В. М. и Куамати О. (2007). Биохимия метаболических процессов. Реверте.
- Нельсон Д.Л., Ленингер А.Л. и Кокс М.М. (2008). Принципы биохимии Ленинга. Macmillan.
- Pertierra, A.G., Gutiérrez, C.V. и др., C.M. (2000). Основы метаболической биохимии. Редакция Tébar.
- Voet, D. & Voet, J. G. (2006). биохимия. Ed. Panamericana Medical.


