Окрашивающая основа Ziehl-Neelsen, реагенты и техника
Окраска Циля-Нильсена в методике окрашивания для выявления устойчивых к действию алкоголя кислотных микроорганизмов (AAR). Название этой микробиологической процедуры относится к ее авторам: бактериологу Францу Цилю и патологу Фридриху Нильсену.
Этот метод представляет собой тип дифференциальной окраски, который подразумевает использование различных красителей для создания контраста между структурами, которые вы хотите наблюдать, дифференцировать и затем идентифицировать. Окраска Циля-Нильсена используется для идентификации определенных типов микроорганизмов.
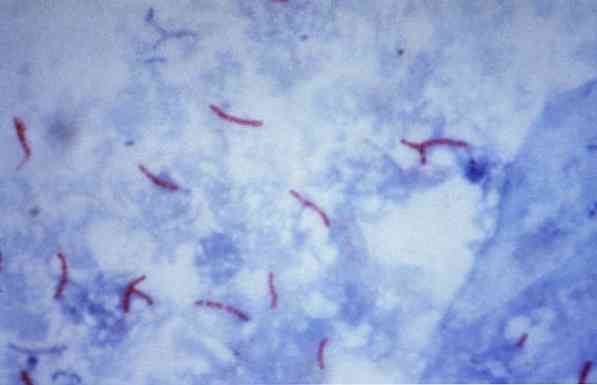
Некоторые из этих микроорганизмов являются микобактериями (например,, Микобактерии туберкулеза) нокардии (например, Nocardia sp.) и некоторых одноклеточных паразитов (например,, Cryptosporidium parvum). Многие из бактерий могут быть классифицированы с помощью общей техники, называемой окраской по Граму..
Однако некоторые бактериальные группы требуют других методов для их идентификации. Такие методы, как окрашивание по Цилю-Нильсену, требуют сочетания красителей с нагреванием, чтобы сначала прикрепить к клеточной стенке..
Затем происходит процесс обесцвечивания, который дает два результата: устойчивость или чувствительность к обесцвечиванию кислотами и спиртами..
индекс
- 1 фундамент
- 1.1 Вторичная окраска
- 2 реагента
- 2.1 Первичная окраска
- 2.2 Обесцвечивающий раствор
- 2.3 Вторичная окраска (анти-краситель)
- 3 Техника
- 3.1 Кислотно-быстрое окрашивание
- 4 Ссылки
фундамент
В основе этой техники окрашивания лежат свойства клеточных стенок этих микроорганизмов. Стенка образована жирными кислотами, называемыми миколиновой кислотой; Они характеризуются очень длинными цепями.
Когда жирные кислоты имеют очень длинную структуру, они могут легче удерживать красители. Некоторые роды бактерий очень трудно окрашивать по Граму, из-за высокого содержания миколевой кислоты в клеточной стенке.
В окраске Циля-Нильсена используется фенольное соединение карбол-фуксин, основной краситель. Это имеет способность взаимодействовать с жирными кислотами клеточной стенки, которая имеет восковую текстуру при комнатной температуре.
Окрашивание карболом фуксина улучшается в присутствии тепла, потому что воск плавится и молекулы красителя быстрее перемещаются в клеточную стенку.
Кислота, которая используется позже, служит для обесцвечивания клеток, которые не были окрашены, потому что их стенка была недостаточно связана с красителем; следовательно, прочность кислотного обесцвечивателя способна удалять кислотный краситель. Клетки, которые противостоят этому обесцвечиванию, называются кислотоустойчивыми.
Вторичная окраска
После обесцвечивания образца это контрастирует с другим красителем, называемым вторичным красителем. Обычно используется метиленовый синий или малахитовый зеленый.
Вторичный краситель окрашивает фоновый материал и, следовательно, создает контраст со структурами, которые были окрашены на первом этапе. Только обесцвеченные клетки поглощают второй краситель (против пятен) и приобретают свой цвет, в то время как кислотостойкие клетки сохраняют красный цвет.
Эта процедура часто используется для идентификации Микобактерии туберкулеза и Mycobacterium leprae, которые называются кислотоустойчивыми бациллами.
реагенты
Первичная окраска
Карбоксин используется 0,3% фуксина (отфильтрованный). Этот краситель готовят из смеси спиртов: фенол в этаноле (90%) или метаноле (95%), и в этой смеси растворяется 3 грамма основного фуксина.
Обесцвечивающий раствор
На этом этапе вы можете использовать растворы 3% спиртовой кислоты или 25% серной кислоты.
Вторичная окраска (анти-краситель)
Краситель, наиболее часто используемый для контрастирования в образцах, обычно составляет 0,3% метиленового синего. Тем не менее, другие также могут быть использованы, такие как 0,5% малахитовый зеленый.
техника
Кислотно-быстрая процедура окрашивания
Приготовить бактериальный мазок
Этот препарат сделан на чистом и сухом предметном стекле, соблюдая меры предосторожности.
Сушка мазка
Разрешить мазок высохнуть при комнатной температуре.
Нагреть образец
Образец должен быть нагрет, применяя огонь к слайду ниже. Фиксация спиртом может быть сделана, когда мазок не был приготовлен с мокротой (обработанной гипохлоритом натрия для отбеливания) и если он не будет окрашен немедленно..
M. tuberculosis Устраняется отбеливателем и в процессе окрашивания. Термофиксация необработанной мокроты не убьет M. tuberculosis, тогда как фиксация алкоголем является бактерицидной.
Прикройте пятно
Пятно покрыто раствором карбол-фуксина (первичное основное пятно).
Нагреть пятно
Это делается за 5 минут. Вы должны заметить выброс пара (примерно 60 ° C). Важно не перегревать и не сжигать образец..
Что касается нагревания пятна, то при нагревании фуксинкарбола следует соблюдать особую осторожность, особенно если окрашивание проводится на лотке или другом контейнере, в котором из предыдущего пятна были собраны легковоспламеняющиеся химические вещества..
Под горками следует наносить только небольшое пламя, используя освещенный тампон, предварительно смоченный несколькими каплями кислого спирта, метанола или 70% этанола. Избегайте использования большого тампона, пропитанного этанолом, потому что это может привести к пожару.
Вымыть пятно
Эта стирка должна быть сделана с чистой водой. Если водопроводная вода не чистая, промойте мазок фильтрованной или дистиллированной водой, желательно.
Покройте мазок кислым спиртом
Этот кислый спирт должен быть на 3%. Покрытие проводится в течение 5 минут или до тех пор, пока мазок не станет достаточно обесцвеченным, то есть бледно-розовым.
Необходимо учитывать, что кислотный спирт легко воспламеняется; поэтому, это должно использоваться очень осторожно. Избегайте быть рядом с источниками возгорания.
Вымыть пятно
Мытье должно быть чистой дистиллированной водой.
Покройте мазок красителем
Это может быть зеленый малахитовый (0,5%) или метиленовый синий (0,3%) краситель в течение 1 или 2 минут, используя самое продолжительное время, если мазок тонкий.
Вымыть пятно
Чистая вода должна использоваться снова (дистиллированная).
истощать
Задняя часть предметного стекла должна быть очищена, и пятно должно быть помещено на дренажную полку, чтобы она была высушена на воздухе (не используйте абсорбирующую бумагу для сушки).
Изучите мазок в микроскоп
Следует использовать объектив 100X и иммерсионное масло. Сканируйте мазок систематически и запишите соответствующие наблюдения.
Интерпретировать результаты
Теоретически, микроорганизмы, окрашенные в красноватый цвет, считаются кислотоустойчивыми (AAR +).
Напротив, если микроорганизмы окрашены в синий или зеленый цвет, в зависимости от красителя, используемого в качестве контр-красителя, они считаются кислотой, устойчивой к воздействию алкоголя (AAR-)..
ссылки
- Апурба С. и Сандхья Б. (2016). Основы практической микробиологии (1-е изд.). Jaypee Brothers Медицинские Издательства.
- Бауман Р. (2014). Микробиология с заболеваниями по системе организма (4-е изд.). Pearson Education, Inc.
- Наследие, Дж., Эванс, Э. и Киллингтон, А. (1996). Вводная микробиология (1-е изд.). Издательство Кембриджского университета.
- Морелло, Дж., Гранато, П. Уилсон, М. и Мортон, В. (2006). Лабораторное руководство и рабочая тетрадь по микробиологии: приложения к уходу за пациентами (11-е изд.). Макгроу-Хилл Образование.
- Васантхакумари Р. (2007). Учебник по микробиологии (1-е изд.). B.I. Публикации PVT.


