Киньюн окрашивание основы и методы
Окрашивание киньюна Это метод окрашивания, используемый для окрашивания кислотоустойчивых бактерий и кислотных паразитов. Он родился от модификации окраски Циля-Нильсена; Оба метода интерпретируются одинаково, но они различаются по двум элементам: при приготовлении основного реагента и в том, что метод Киньюна не использует тепло.
По этой причине он также известен как холодное модифицирование холодным окрашиванием Циля-Нильсена или Киньюна. Это указано для окраски Микобактерии туберкулеза, Mycobacterium leprae, атипичные микобактерии, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris и Cyclosporas cayetanensis.
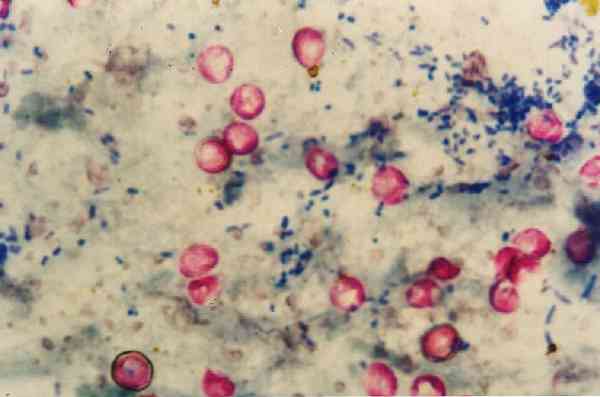
Стоит отметить, что при этой методике Nocardias слабо окрашиваются, поскольку они являются частично кислотоустойчивым спиртом, поэтому для этого жанра существует модификация методологии..
В свою очередь, метод холодного Киньюна был объединен с трихромным методом, модифицированным Дидье для обнаружения кокцидий (Cryptosporidium parvum и Изоспора Белли) и споры микроспоридий (Enterocytozoon bieneusi и Encephalitozoon intestinalis).
индекс
- 1 фундамент
- 2 Техника
- 2.1 Материалы
- 2.2 Приготовление финсинированного фуцином киньюна
- 2.3 Приготовление спиртовой кислоты
- 2.4 Приготовление контрастного красителя метиленового синего
- 2.5 Техника окрашивания Киньюна
- 2.6 Специальная техника Киньюна для нокардии
- 2.7 Комбинированная техника фенольного и трихромного фуксина, модифицированного Дидье
- 2.8 Контроль качества
- 3 Техника Киньюна по сравнению с техникой Циля-Нильсен
- 4 Ссылка
фундамент
Основным окрашивающим реагентом является карбол-фуксин или фуксин-феникада, который обладает свойством связываться с карболовыми кислотами, существующими в восковой клеточной стенке, богатыми липидами (миколиновые кислоты) микобактерий и некоторых паразитов..
Этому союзу не противодействует кислотное обесцвечивание; следовательно, микроорганизмы определяются как кислотоустойчивый спирт.
В отличие от метода Циля-Нильсена, который фиксирует краситель при нагревании, в методе Киньюна этот шаг не является необходимым, поскольку раствор фенольного фуксина, приготовленный для этого метода, содержит высокую концентрацию фенола..
Фенол растворяет липидный материал клеточной стенки, что обеспечивает проникновение карбол-фуксинового красителя. После того, как краситель проникает, он остается фиксированным, несмотря на промывание спиртовой кислотой.
Таким образом, кислотоустойчивые микроорганизмы приобретают характерный красный цвет, в то время как все, что не является кислотоустойчивым спиртом, обесцвечивается и окрашивается в синий цвет..
техника
материалы
- Модифицированный фенольный фуксин.
- Алкоголь -уксусный.
- Метиленовый синий.
Приготовление Киньюна феницированного фуксина
- Основной фуксин: 4 гр.
- Фенол: 8 мл.
- Алкоголь (95%): 20 мл.
- Дистиллированная вода: 100 мл.
Основной фуксин в спирте должен медленно растворяться, постоянно перемешиваться. Затем кристаллизованный фенол расплавляют на водяной бане при 56 ° С. После растворения добавьте 8 мл к раствору фуксина, приготовленному выше..
Приготовление спиртовой кислоты
- Концентрированная соляная кислота: 3 мл.
- Этанол (95%): 97 мл.
Это должно быть измерено, соединено и смешано.
Приготовление метиленового синего контрастного красителя
- Метиленовый синий: 0,3 г.
- Дистиллированная вода: 100 мл.
Взвешивается и растворяется.
Техника окраски киньюн
1- Подготовьте мазок непосредственно из образца, который, среди прочего, может быть мокротой, легочной жидкостью, осадком мочи, спинномозговой жидкостью или калом; или из суспензии микроорганизмов, полученных из чистых колоний, выработанных в первичных культуральных средах.
2- исправить мазок с теплом.
3. Поместите мазок на окрашивающую перемычку и накройте приготовленным фенольным реагентом Киньюна. Оставьте на 3 или 5 минут.
4- промыть дистиллированной водой.
5- Отбелить кислым спиртом в течение 3 минут и снова промыть дистиллированной водой..
6 - снова отбелить кислым спиртом в течение 1 или 2 минут, пока не перестанет краситься.
7- Промойте дистиллированной водой и дайте стечь, поместив предметное стекло в вертикальное положение..
8- Покройте препарат метиленовым синим и оставьте на 4 минуты..
9- Промыть дистиллированной водой и дать высохнуть на воздухе.
10- Осмотрите в 40X и затем в 100X.
Если вы хотите улучшить и ускорить окрашивание кислотоустойчивых микроорганизмов, добавьте 1 каплю смачивающего агента (такого как тергитол № 7) к 30 или 40 мл фенольного фуксина Киньюна..
Некоторые лаборатории меняют контрастный краситель метиленовый синий на ярко-зеленую или пикриновую кислоту; первый придает фону зеленый цвет, а второй - желтый цвет.
Техника Киньюн специально для нокардии
Для улучшения окрашивания бактерий Nocardia используется модификация окрашивания Kinyoun. Техника заключается в следующем:
1- Покройте мазок фенисином, обработанным Kinyoun, в течение 3 минут..
2- Промыть дистиллированной водой.
3- Кратковременно отбеливайте 3% -ным приготовленным кислотным спиртом до тех пор, пока не перестанет поступать краска.
4- снова промойте дистиллированной водой.
5- Покройте препарат метиленовым синим и оставьте на 30 секунд..
6- Промойте дистиллированной водой и дайте высохнуть на воздухе.
Комбинированная техника фенольного и трихромного фуксина, модифицированного Дидье
Этот метод рекомендуется для анализа образцов кала в поисках кокцидий и спор Microsporidium sp в то же время Процедура, которой необходимо следовать, заключается в следующем:
1- Покройте мазок фенольным фуксином Киньюна на 10 минут..
2- Удалить краситель и промыть дистиллированной водой.
3- отбелить в течение 30 секунд спиртом соляной кислотой.
4- снова промойте дистиллированной водой.
5- Покройте мазок раствором трихрома в течение 30 минут при 37 ° C..
6- Промыть дистиллированной водой.
7- Обесцвечивать в течение 10 секунд спиртом уксусной кислотой.
8- Вымойте мазок в течение 30 секунд, используя 95% этанол.
Контроль качества
В качестве положительного контроля мазки готовятся с использованием штаммов Микобактерии туберкулеза и окрашивают подготовленными реагентами, чтобы убедиться, что бактерии приобретают правильный цвет (красно-фуксия).
Отрицательные контроли также можно использовать, готовя мазки с любым штаммом, который не является кислотоустойчивым спиртом, таким образом проверяя, что весь образец приобретает контрастный цвет.
Техника Киньюна по сравнению с техникой Циля-Нильсен
Техника Киньюна проще, потому что она исключает этап нагревания, но ее главное преимущество заключается в том, что она предотвращает выброс паров, очень токсичных и вызывающих рак в долгосрочной перспективе. Поэтому окрашивание по Киньюну безопаснее для окрашивания персонала..
Важно учитывать, что необходимо следить за тем, чтобы реагенты не вступали в непосредственный контакт с кожей, поскольку они вызывают коррозию и отбеливатель легко воспламеняется..
Что касается недостатков, отрицательный мазок не обязательно указывает на то, что микроорганизм отсутствует. Кроме того, наличие клеточного детрита может вызывать ложные срабатывания, что порождает путаницу в диагностике.
ссылка
- Прикладная клиническая химия (2016). BK Kinyoun Kit. Доступно по адресу: cromakit.es
- Ороско-Рико Мигель. Пятно Киньюна и две кокцидии при ВИЧ. Медицинский журнал MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Микробиологическая диагностика Бэйли и Скотта. 12 изд. Аргентина. Panamericana S.A Редакция.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Микробиологический диагноз. (5-е изд.). Аргентина, редакция Panamericana S.A..
- Участники Википедии. "Пятно Киньюна." Википедия, Свободная энциклопедия. Википедия, Свободная энциклопедия, 8 февраля 2018. Веб. 5 января 2019 г..
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Применение метода окраски для одновременной диагностики кокцидий и микроспоридий. Институт гигиены Университета республики. Монтевидео. Уругвай. Доступно по адресу: higiene.edu.uy


