Основа для окраски по Граму, материалы, техника и использование
Грамное пятно это самый простой и полезный метод окрашивания в диагностической микробиологии. Этот метод был создан датским доктором Гансом Кристианом Грамом в 1884 году, которому удалось классифицировать бактерии по грамположительным и грамотрицательным по составу клеточной стенки..
Метод подвергся определенным модификациям Хакера в 1921 году для стабилизации реагентов и улучшения качества окраски, так что окраска Грамма также известна как Грам-Хакер..
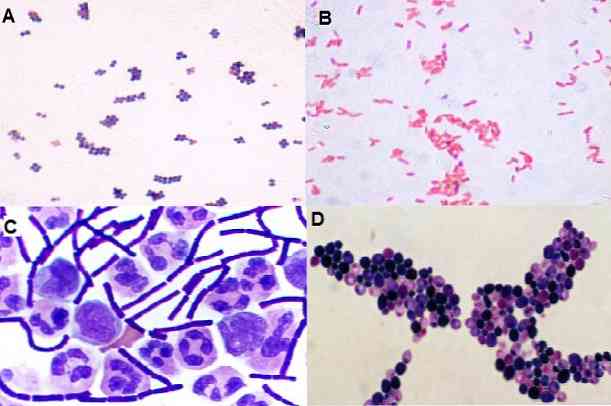
С помощью этой методики также можно наблюдать форму, которую имеют микроорганизмы, то есть, среди прочего, являются ли они кокки, бациллы, коккобациллы, плеоморфные, нитевидные. А также его распределение в пространстве: в кластере, в цепочке, изолированно, в парах, в тетрадах и т. Д..
При подозрении на бактериальную инфекцию большую часть полученных образцов следует распределить на предметном стекле и окрашивать по Граму для исследования под микроскопом..
Отчет Грамма поможет врачу определить, какой тип микроорганизма может быть причиной инфекции, до получения окончательного результата урожая..
В некоторых случаях жизнь пациента сильно нарушена, поэтому врачам срочно нужен отчет Грамма, чтобы провести эмпирическое лечение, ожидая выявления микроорганизма..
Например, если Грамм обнаруживает, что в спинномозговой жидкости есть грамположительные кокки, врач проведет первоначальную терапию антибиотиками, которые уничтожают этот тип бактерий, в соответствии с протоколами, установленными для него..
Как только будет получен окончательный результат с названием изолированного микроорганизма и соответствующей антибиограммой, врач оценит, стоит ли менять терапию. Это решение будет принято в соответствии с изучением чувствительности микроорганизма к принимаемым им антибиотикам и эволюции пациента..
индекс
- 1 фундамент
- 2 Материалы
- 3 Приготовление красителей и реагентов
- 3.1 Кристаллический фиолетовый раствор
- 3.2 Йодо-Люголь
- 3.3 Отбеливание
- 3.4 Контраст
- 4 Хранение реагентов
- 5 Подготовка распределения образца для окрашивания
- 5.1-грамм прямых образцов
- 5.2-грамм урожая
- 6 Техника
- 7 Полезность
- 8 распространенных ошибок
- 9 Ссылки
фундамент
Это техника, которая представляет 4 основных этапа: окрашивание, фиксация с помощью протравы, изменение цвета и сглаживание. Поэтому этот метод помимо окрашивания бактерий, также отличает их.
Кристаллический фиолетовый - первый используемый краситель. Он обладает сродством к пептидогликану, и пурпурный цвет окрасит все присутствующие бактерии, затем помещается люгол, который действует как протрава, то есть он вызывает образование нерастворимых комплексов кристаллического фиолетового-йода - рибонуклеиновых белков внутри клетки..
Грамположительные бактерии, имеющие толстую стенку пептидогликана, образуют больше комплексов (кристаллический фиолетовый-йод), поэтому они сохраняют краситель.
Это также влияет на то, что стенка грамположительных бактерий содержит большее количество ненасыщенных кислот, которые проявляют высокое сродство к окислителям (люгол).
Между тем, грамотрицательные бактерии имеют тонкий слой пептидогликана, что делает бактерии менее сложными, чем грамположительные бактерии..
Затем наступает этап обесцвечивания, когда грамположительные и грамотрицательные бактерии ведут себя по-разному..
Грамотрицательные бактерии содержат внешнюю мембрану, богатую липополисахаридами, которая является частью ее клеточной стенки. Жиры разрушаются при контакте с ацетоном спирта, поэтому дестабилизируется внешняя мембрана, выделяется фиолетовый кристалл.
Вот как это затем контрастирует с сафранином или основным фуксином, принимая красный цвет.
В случае грамположительных бактерий они сопротивляются обесцвечиванию, потому что отбеливатель действует, чтобы закрыть поры, что препятствует выходу кристаллического фиолетового / йодного комплекса.
Поэтому окраска с фиолетовым кристаллом стабильна, и нет места для сафранина или фуксина. Из-за этого эти бактерии окрашивают интенсивный синий или фиолетовый.
материалы
Раскраска Грамм состоит из:
- Фиолетовый кристалл
- люголь
- Ацетоновый спирт
- Сафранин или основной фуксин
Приготовление красителей и реагентов
Кристаллический фиолетовый раствор
Решение А:
Фиолетовый кристалл -2 гр
Этиловый спирт 95% -20cc
Решение Б:
Оксалат аммония -0,8 гр
Вода дистиллированная - 80 куб.
Для окончательного приготовления фиолетового кристалла раствор 1:10 следует разбавить дистиллированной водой и смешать с 4 частями раствора B. Перед использованием смесь хранится в течение 24 часов. Фильтруют в колбу для окрашивания янтаря с помощью бумажного фильтра..
Количество, которое будет использоваться ежедневно, переносится в янтарную бутылку с капельницей.
Йод-Люголя
Взвесьте и измерьте указанное количество каждого соединения следующим образом:
Кристаллы Йодо - 1гр
Калия йодид - 2гр
Вода дистиллированная -300 куб.см
Йодид калия постепенно растворяется в воде, а затем добавляется йод. Раствор побрился в бутылку янтарного цвета.
Количество, которое будет использоваться ежедневно, переносится в меньшую янтарную бутылку с капельницей.
обесцвечивание
95% этиловый спирт -50 мл
Ацетон - 50 мл
Он готовится в равных частях. Накройте хорошо, это имеет тенденцию испаряться.
Поместите в бутылку с капельницей.
Этот препарат обеспечивает обесцвечивание в умеренное время 5-10 секунд и является наиболее рекомендуемым.
Новички предпочитают использовать только 95% этиловый спирт, где обесцвечивание происходит медленнее, от 10 до 30 секунд..
В то время как самые опытные могут использовать чистый ацетон, где изменение цвета происходит очень быстро от 1 до 5 секунд.
контрастировать
Сафраниновый маточный раствор
Сафранина -2,5 гр
Этиловый спирт 95% -100 куб.
После взвешивания указанное количество сафранина растворяется в 100 см 3 этилового спирта до 95%..
Рабочий раствор сафранина готовят из исходного раствора..
Для этого отмерьте 10 см 3 исходного раствора, добавьте 90 см 3 дистиллированной воды до 100 мл..
Рекомендуется перевести количество, которое будет использоваться ежедневно, в янтарную бутылку с капельницей.
Микроорганизмы, которые слабо окрашивают по Граму-Гекеру, например, некоторые анаэробы, Legionella sp., Campylobacter sp. И Brucella sp., они могут быть намного лучше окрашены, если используется модификация, сделанная Kopeloff для окрашивания по Граму-Хакеру, называемая окраской по Граму-Копелу..
Этот метод заменяет краситель сафранина на основной фуксин. С этой модификацией возможно эффективно окрашивать вышеупомянутые микроорганизмы.
Хранение реагентов
Подготовленные красители следует хранить при комнатной температуре.
Подготовка пробы к окраске
Образец должен содержать не менее 105 микроорганизмы перед наблюдением микроорганизмов в мазке, скорее всего. Спреды могут быть сделаны из прямого образца или культур в твердой или жидкой среде..
Спрэды должны быть равномерными, хорошо распределенными и не слишком толстыми для лучшей визуализации имеющихся структур.
-Грамм прямых образцов
Грамм мочи без центрифуги
Мочу смешивают и 10 мкл помещают на предметное стекло. Наблюдение, по крайней мере, одного поля бактерий / иммерсии указывает на наличие инфекции.
Это означает, что культура будет иметь приблизительно более 100 000 КОЕ / мл (105 КОЕ / мл) мочи в 85% случаев.
Этот метод бесполезен при количестве колоний ниже 100 000 КОЕ.
LCR Gram
CSF должен быть центрифугирован, супернатант удален, а осадок распределен на предметном стекле. Эта жидкость стерильна при нормальных условиях; наблюдение бактерий указывает на инфекцию.
Грамм дыхательных проб
Грамм мокроты, бронхиальный или бронхоальвеолярный лаваж, хотя могут присутствовать различные микроорганизмы, всегда будут помогать в диагностике, помимо того, что они полезны, тип наблюдаемых клеток.
В случае мокроты, мазок должен быть подготовлен с наиболее гнойными частями образца.
Табурет Грам
Не рекомендуется выполнять грамму для этого типа образцов, так как он не имеет диагностического значения.
-Граммовые культуры
Их можно сделать двумя способами: один из жидких культур, а другой из твердых культур..
Жидкие культуры
Из жидких культур это чрезвычайно просто; под зажигалку берут несколько жареных мутных бульонов и помещают их на чистое и сухое предметное стекло, совершая круговые движения от центра к периферии, чтобы равномерно распределить материал.
Допускается самопроизвольное высыхание на воздухе. После высыхания материал фиксируется на листе при нагревании. Для этого с помощью зажима лист 3 4 раза пропускают через пламя горелки Бунзена, стараясь не обжечь материал..
Листу дают остыть и помещают на окрашивающий мост.
Твердые культуры
Чтобы выполнить продление для окрашивания по Граму из твердой культуры, выполните следующие действия:
Прежде чем выбрать колонии для взятия, следует подготовить предметное стекло, поместив примерно две капли стерильного физиологического солевого раствора..
Если исходная культуральная пластина содержит несколько разных типов колоний, для выполнения грамма будет выбрана отдельная колония каждой из них. Каждая колония будет взята с платиновой петлей, чтобы растворить ее в физиологическом растворе, предварительно помещенном на предметное стекло..
Круговые движения даны от центра к периферии, чтобы равномерно распределить колонию на предметном стекле..
Допускается самопроизвольное высыхание на воздухе. После высыхания лист фиксируется нагреванием, как объяснено выше (зажигание предметного стекла зажигалкой), стараясь не обжечь материал..
Эта процедура должна быть выполнена с каждым другим типом колонии. На листе бумаги следует отметить порядок наблюдения, например:
Колония 1: желтая бета-гемолитическая колония: грамположительные кокки наблюдались в кластерах
Колония 2: Кремовая колония, без гемолиза: грамотрицательных коккобацилл не наблюдалось..
Каждый лист должен быть помечен, чтобы знать, что мы наблюдаем.
техника
Методика окрашивания по Граму чрезвычайно проста в исполнении и относительно недорога и не может быть пропущена в лаборатории микробиологии.
То же самое делается следующим образом:
- Зафиксируйте мазок теплом и поместите на цветной мост.
- Простыня полностью покрыта фиолетовым стеклом за 1 минуту.
- Вымойте водой. Не сушить
- Накройте планшет раствором Люголя, оставьте на 1 минуту. Вымойте водой. Не сушить.
- Смешайте в течение 5-10 секунд при осторожном перемешивании в ацетоновом спирте. Или поместите лист в вертикальное положение и уроните капли обесцвечивающего агента на поверхность, пока оставшееся фиолетовое стекло не утащит. Не превышать.
- Вымойте водой. Не сушить.
- Замените лист на цветном мостике и накройте на 30 секунд сафранином (Грам-Хакер) или 1 минутой на основной фуксин (Грам-Копелов).
- Мыть водой
- Разрешить спонтанно высохнуть в вертикальном воздухе.
После высыхания поместите 1 каплю иммерсионного масла, чтобы увидеть его под объективом 100X в оптическом микроскопе..
утилита
Эта методика позволяет различать морфотипические различия большинства бактерий..
Дрожжи также отличаются этим цветом. Они берут кристалл фиолетовый, то есть окрашивают грамположительный.
С другой стороны, можно выделить грамположительные спорообразующие бациллы, в которых внутри бацилл наблюдается свободное пространство, где сформировалась эндоспора, хотя споры плохо окрашиваются. Чтобы использовать споры, используются другие методы, такие как Шеффер-Фултон.
Следует отметить, что это пятно не служит для окрашивания всех видов бактерий, то есть есть случаи, когда окрашивание не работает.
В этом случае можно упомянуть бактерии, лишенные клеточной стенки. Например: род Mycoplasma, сферопласты, уреаплазмы, L-формы и протопласты.
Он также плохо окрашивает бактерии со стенками, богатыми миколиновыми кислотами, такими как микобактерии, и внутриклеточными бактериями, такими как хламидии и риккетсии..
Также неэффективно окрашивать большинство спирохетальных бактерий..
Есть бактерии того же рода, которые можно наблюдать в том же образце, что и грамположительные и грамотрицательные. Когда это происходит, это называется переменным окрашиванием по Граму, что может быть связано с изменением питательных веществ, температуры, pH или концентрации электролитов..
Распространенные ошибки
Отбеливатель чрезмерно
Преувеличивание на этапе обесцвечивания может привести к наблюдению ложных грамотрицательных микроорганизмов.
Не ждите достаточно времени для сушки, чтобы добавить иммерсионное масло:
Эта ошибка вызывает образование жировых мицелл, которые затрудняют наблюдение за присутствующими структурами. Это происходит, когда масло соединяется с молекулами воды, присутствующими в мазке..
Обратный порядок реагентов:
Ошибка, подобная этой, приведет к тому, что грамотрицательные бактерии станут фиолетовыми, то есть ложными..
Используйте старые культуры (твердые или жидкие):
Это может привести к тому, что грамположительные бактерии окрашивают грамотрицательные (ложно грамотрицательные). Это происходит потому, что в старых культурах вероятно, что есть мертвые или испорченные бактерии, и в этих условиях бактерии не сохраняют фиолетовый кристалл..
Используйте очень старый раствор Люголя:
Со временем люголь теряет свои свойства, а цвет исчезает. Если используется уже дегенерированный реагент, он не будет хорошо фиксировать кристаллический фиолетовый, поэтому существует возможность получения визуализации микроорганизмов, ложно грамотрицательных.
Голубоватый фон
Правильно обесцвеченный фон будет красным. Синий фон указывает на то, что изменение цвета было недостаточным.
ссылки
- Райан К.Дж., Рэй С. 2010. Sherris. микробиология Медицинский, 6-е издание McGraw-Hill, Нью-Йорк, США
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Микробиологический диагноз. (5-е изд.). Аргентина, редакция Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Микробиологическая диагностика Bailey & Scott. 12 изд. Аргентина. Panamericana S.A Редакция
- Касас-Ринкон Г. 1994. Общая микология. 2-е изд. Центральный университет Венесуэлы, Библиотечные издания. Венесуэла, Каракас.
- "Грамное пятно" Википедия, Свободная энциклопедия. 4 октября 2018 года, 23:40 UTC. 9 декабря 2018 года, 17:11. Взято с es.wikipedia.org.
- Гонсалес М., Гонсалес Н. 2011. Руководство по медицинской микробиологии. 2-е издание, Венесуэла: Дирекция СМИ и публикаций Университета Карабобо.
- Лопес-Жаком Л, Эрнандес-Дуран М, Колин-Кастро С, Ортега-Пенья С., Керон-Гонсалес Г., Франко-Сендехас Ф. Базовое окрашивание в лаборатории микробиологии. Исследования по инвалидности. 2014; 3 (1): 10-18.


