Окрашивание основы Гимзы, материалы, техника и использование
Гимза пятно это тип окрашивания клинических образцов, основанный на смеси кислотных и основных красителей. Его создание было вдохновлено работой, проделанной Романовским, где Густав Гимса, химик и бактериолог из Германии, усовершенствовал его, добавив глицерин для стабилизации соединений..
Изменения, внесенные в оригинальную технику Романовского, позволили значительно улучшить микроскопические наблюдения, поэтому метод был крещен с именем окраски Гимзы..
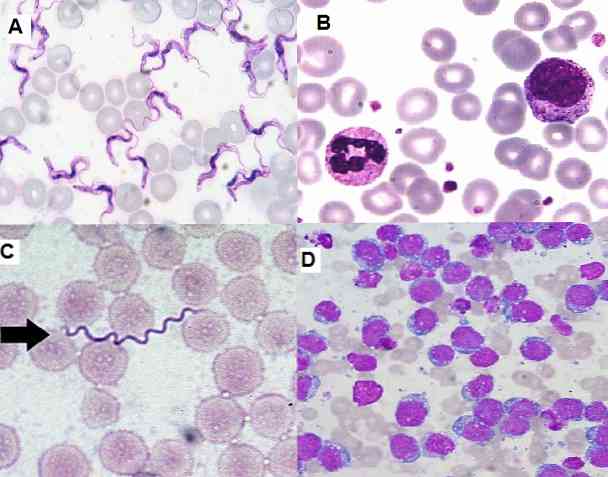
Поскольку это простой метод для выполнения, высоко функциональный и экономичный, в настоящее время он широко используется в клинической лаборатории для гематологических мазков, образцов костного мозга и срезов тканей..
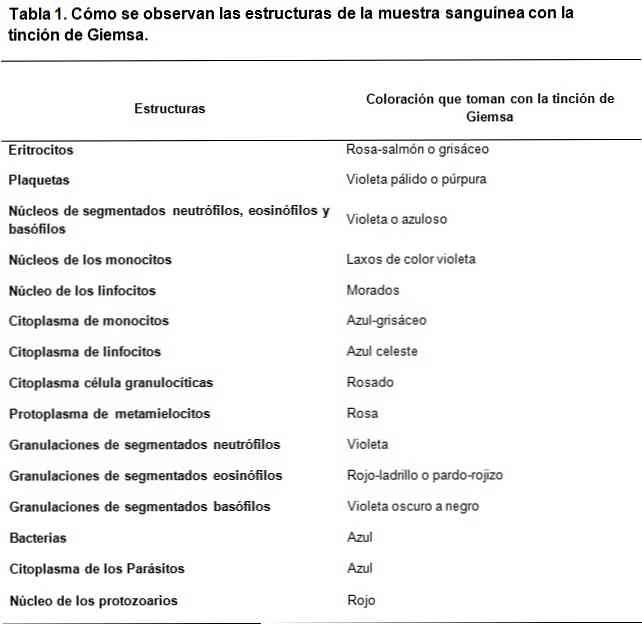
Техника окрашивания по Гимзе очень полезна для цитологических исследований, так как позволяет наблюдать специфические структуры клеток. Этот метод окрашивает цитоплазмы, ядра, ядрышки, вакуоли и гранулы клеток, что позволяет различать даже мелкие следы хроматина.
Кроме того, могут быть обнаружены значительные изменения в размере, форме или окраске ядра, где можно визуализировать потерю связи ядро-цитоплазма..
С другой стороны, он позволяет выявлять незрелые клетки в костном мозге и периферической крови, что важно для диагностики серьезных заболеваний, таких как лейкемия. Также возможно обнаруживать гемопаразиты, экстра- и внутриклеточные бактерии, грибы и др..
В цитогенетике это вполне используется, так как можно изучать митоз клеток.
индекс
- 1 Основа окраски Гимзы
- 2 Материалы
- 2.1 Материалы для приготовления материнского раствора
- 2.2 Режим приготовления материнского раствора
- 2.3 Материалы для приготовления буферного раствора
- 2.4 Окончательная подготовка красителя
- 2.5 Дополнительные материалы, необходимые для выполнения окраски
- 3 Техника
- 3.1 Процесс окрашивания
- 4 Утилиты
- 4.1 Гематология
- 4.2 Микология
- 4.3 Бактериология
- 4.4 Паразитология
- 4.5 Цитология
- 4.6 Цитогенетика
- 5 Исследования, демонстрирующие эффективность окрашивания по Гимзе
- 6 рекомендаций по хорошему окрашиванию
- 7 распространенных ошибок в раскраске Гимзы
- 7.1 Чрезвычайно синяя окраска
- 7.2 Чрезмерно розовая окраска
- 7.3 Наличие осадков в мазке
- 7.4 Наличие морфологических артефактов
- 8 Режим хранения
- 9 Ссылки
Основание окраски Гимзы
Красители типа Романовского основаны на использовании контраста между кислотными и основными красителями для достижения окрашивания основных и кислотных структур, соответственно. Как можно видеть, существует сродство кислотных красителей к окрашиванию основных структур и наоборот..
Основной используемый краситель - метиленовый синий и его окисленные производные (Azure A и Azure B), в то время как кислотный краситель - эозин..
Кислотными структурами клеток являются, среди прочего, нуклеиновые кислоты, гранулы сегментированных базофилов, поэтому они будут окрашены метиленовым синим..
В этом же смысле основными структурами клеток являются, среди прочего, гемоглобин и некоторые гранулы, такие как те, которые содержатся в сегментированных эозинофилах; они будут окрашены эозином.
С другой стороны, из-за того, что метиленовый синий и лазурь характеризуются метахроматическими красителями, они могут придавать переменный тон различным структурам в зависимости от нагрузки на полианионы, которыми они обладают..
Таким образом, стратегическое сочетание основных и кислотных красителей способно создавать широкий спектр цветов в соответствии с биохимическими характеристиками каждой структуры, проходя через бледно-голубой, темно-синий, сиреневый и фиолетовый тона в случае кислотных структур..
В то время как окраска, обеспечиваемая эозином, является более стабильной, образуются цвета между красновато-оранжевым и лососевым.
материалы
Материалы для приготовления материнского раствора
Приготовление исходного раствора требует взвешивания 600 мг порошкообразного красителя Гимза, измерения 500 см 3 безметонового метилового спирта и 50 см 3 нейтрального глицерина.
Режим приготовления материнского раствора
Поместите тяжелый порошок Гимзы в ступку. Если есть комки, их следует опрыскивать. Затем добавьте значительное количество отмеренного глицерина и очень хорошо перемешайте. Полученную смесь разливают в очень чистую янтарную бутылку.
Остальная часть глицерина помещается в ступку. Смешайте еще раз, чтобы очистить оставшийся краситель, прилипший к стенкам раствора, и вылейте в ту же бутылку..
Бутылку накрывают и выдерживают в течение 2 часов на водяной бане при 55ºC. Находясь в ванне на водяной бане, слегка перемешивайте смесь каждые полчаса или около того.
Затем смеси дают остыть для размещения спирта. Ранее часть отмеренного спирта помещают в ступку, чтобы закончить промывание остатка красителя, а затем добавляют к смеси вместе с остальным спиртом..
Этот препарат должен быть выдержан в течение не менее 2 недель. Часть, которая используется материнского раствора должна быть отфильтрована.
Чтобы избежать загрязнения препарата, рекомендуется передавать порцию, которая будет постоянно использоваться, в небольшую янтарную бутылочку с капельницей. Подзаряжайте каждый раз, когда заканчивается реагент.
Материалы для приготовления Буферного раствора
С другой стороны, буферный раствор при рН 7,2 готовят следующим образом:
Взвешивают 6,77 г фосфата натрия (безводного) (NaHPO4), 2,59 г дигидрофосфата калия (KH)2ПО4) и дистиллированная вода до 1000 куб..
Окончательная подготовка красителя
Для приготовления конечного окрашивающего раствора измеряют 2 см 3 отфильтрованного маточного раствора и смешивают с 6 см 3 буферного раствора. Смесь перемешивают.
Важным фактом, который необходимо учитывать, является то, что методы приготовления красителя могут меняться в зависимости от коммерческого дома.
Дополнительные материалы, необходимые для выполнения окраски
Помимо описанных материалов, он должен быть снабжен цветными мостиками, водяными экранами или буфером для стирки, листами для предметов или крышек, секундомером для контроля времени окрашивания и промокательной бумагой или некоторым материалом, который можно использовать для сушки ( марля или хлопок).
техника
Процесс окрашивания
1) Перед окрашиванием необходимо нанести образец на чистое предметное стекло..
Образцы могут быть кровью, костным мозгом, срезами гистологических тканей или шейно-вагинальными образцами. Рекомендуется, чтобы наружная сторона была тонкой и имела 1 или 2 часа высыхания перед окрашиванием.
2) Все листы, которые вы должны раскрасить, помещены на цветной мост. Всегда работайте в одном и том же порядке и хорошо идентифицируйте каждый лист.
3) Поместите несколько капель 100% метилового спирта (метанола) на мазок и оставьте на 3-5 минут, чтобы зафиксировать и обезвоживать образец..
4) Откажитесь от метанола, присутствующего в листе, и дайте высохнуть на воздухе.
5) После высыхания поместите окончательный окрашивающий раствор капельницей, пока весь лист не будет покрыт. Оставить на 15 минут. Некоторые авторы рекомендуют до 25 мин. Зависит от коммерческого дома.
6) Слейте краситель и промойте мазок дистиллированной водой или 7,2 буферным раствором..
7) На промокательной бумаге дайте листам высохнуть на открытом воздухе, расположив их вертикально с помощью подставки..
8) Протрите заднюю часть слайда марлей или ватным тампоном, смоченным в спирте, чтобы удалить оставшийся краситель..
коммунальные услуги
Техника окрашивания Гимзы используется в нескольких областях, в том числе: гематология, микология, бактериология, паразитология, цитология и цитогенетика..
гематология
Это наиболее частая полезность, которая дается для этого окрашивания. С его помощью мы можем идентифицировать каждую из клеток, присутствующих в образцах костного мозга или периферической крови. А также оценка количества каждой серии, возможность обнаружить лейкоцитоз или лейкопению, тромбоцитопению и т. Д..
Поскольку он чувствителен для выявления незрелых клеток, он имеет отношение к диагностике острых или хронических лейкозов. Также возможно диагностировать анемию, такую как серповидно-клеточная анемия, серповидно-клеточная анемия и др..
микология
В этой области обычно используют его для поиска Histoplasma capsulatum (внутриклеточный диморфный гриб) в образцах тканей.
бактериология
В гематологических мазках, окрашенных по Гимзе, можно обнаружить Borrelias sp у пациентов, которые имеют заболевание под названием лихорадка рецидивирующая. Спирохеты распространены среди эритроцитов в образцах, взятых на фебрильном пике..
Также можно визуализировать внутриклеточные бактерии как Rickettsias sp и Chlamydia trachomatis в инфицированных клетках.
паразитология
В области паразитологии окрашивание по Гимзе позволило диагностировать такие паразитарные заболевания, как малярия, болезнь Шагаса и лейшманиоз..
В первых двух паразитах Plasmodium sp и Трипаносома Крузи соответственно они могут быть визуализированы в периферической крови инфицированных пациентов, они могут быть обнаружены на разных стадиях в зависимости от фазы, в которой заболевание.
Для улучшения поиска паразитов крови рекомендуется использовать краситель Гимза, смешанный с красителем Май-Грюнвальд.
Кроме того, кожный лейшманиоз можно диагностировать при оценке образцов биоптатов кожи, окрашенных по Гимзе, где обнаружен паразит..
цитология
Окрашивание по Гимзе также используется для цитологического исследования эндоцервикальных образцов, хотя это не самый часто используемый метод для этой цели..
Но в случаях нехватки ресурсов можно использовать, имея функциональность, аналогичную той, которая предлагается по методике Папаниколау, и с меньшими затратами. Тем не менее, это требует экспертизы со стороны эксперта.
цитогенетики
Важной особенностью окрашивания Гимзы является его способность сильно связываться с областями, богатыми аденинами ДНК и тиминами. Это позволяет визуализировать ДНК во время митоза клеток, в разных состояниях конденсации.
Эти исследования необходимы для выявления хроматических аберраций, таких как дупликации, делеции или транслокации различных областей хромосом..
Исследование, демонстрирующее эффективность окрашивания по Гимзе
Cannova et al. (2016) сравнили 3 метода окраски для диагностики кожного лейшманиоза.
Для этого они использовали образцы, полученные от экспериментального животного (Mesocrisetus auratus) экспериментально привит с лейшмании.
Авторы продемонстрировали, что окрашивание по Гимзе было лучше, чем по окрашиванию Pap-mart® и Gaffney. Поэтому они считали, что пятно Гимзы идеально подходит для диагностики кожного лейшманиоза..
Отличные результаты, полученные авторами, объясняются тем, что комбинация красителей, составляющих смесь Гимзы, создает необходимые условия для создания благоприятного контраста, позволяющего четко различать структуры амастигота как внутри, так и вне клетки..
Другие методы (Pap-mart® и Gaffney) также делали это, но более слабым способом и, следовательно, более трудным для визуализации. Вот почему пятно Гимзы рекомендуется для паразитологической диагностики лейшманиоза.
Аналогичным образом, исследование, проведенное Ramírez и соавторами (1994), оценило валидность пятен Гимзы и Лендрума в мазках из конъюнктивы для идентификации Chlamydia trachomatis.
Авторы определили, что окрашивание Гимзы и Ледрума имеет одинаковую специфичность, но Гимза была более чувствительной.
Это объясняет, почему в настоящее время окрашивание по Гимзе является наиболее часто используемым для диагностики хламидийных инфекций, особенно если ресурсов мало.
Рекомендации по хорошему окрашиванию
Сушка листов не должна быть ускорена. Пруденциальное время следует ждать, чтобы высушить его на открытом воздухе. Примерно 2 часа.
Цвет сразу после 2 часов для достижения наилучших результатов.
Для лучшего закрепления и окрашивания мазков образец должен быть распределен на листе таким образом, чтобы остался тонкий и равномерный слой..
Предпочтительным образцом крови является капилляр, так как мазок сделан непосредственно из капли крови, и поэтому в образце нет добавки, которая способствует поддержанию клеточных структур..
Однако, если используется венозная кровь, ЭДТА следует использовать в качестве антикоагулянта, а не гепарина, поскольку последний обычно деформирует клетки.
Распространенные ошибки в раскраске Гимзы
В практике этой раскраски могут быть допущены ошибки. Об этом свидетельствуют внезапные изменения оттенков конструкций.
Чрезвычайно синяя окраска
Это может быть связано с:
- Очень густые мазки
- Превышение времени окрашивания
- Слишком мало стирки.
- Использование реагентов значительно выше нейтрального рН (щелочной).
В этих условиях цвета следующих структур искажаются, так что эритроциты вместо умирающего розового лосося будут выглядеть зелеными, гранулы эозинофилов, которые должны быть окрашены в красный кирпич, станут синими или серыми и так далее, отклонение в обычных тональностях.
Чрезмерно розовая окраска
Это может быть связано с:
- Недостаточное время окрашивания.
- Длительная или чрезмерная стирка.
- Плохая сушка.
- Использование очень кислых реагентов.
В этом конкретном случае структуры, которые обычно окрашены в синий цвет, будут почти не видны, в то время как структуры, которые окрашены в розовый цвет, будут иметь очень преувеличенные тональности.
Пример: эритроциты приобретут ярко-красный или ярко-оранжевый цвет, ядерный хроматин будет выглядеть бледно-розовым, а гранулы эозинофилов станут ярко-красными..
Наличие осадков в мазке
Причины могут быть:
- Используйте грязные или плохо вымытые простыни.
- Не позволяйте мазку хорошо высохнуть.
- Оставьте решение для фиксации слишком долго.
- Неадекватная стирка в конце окрашивания.
- Неадекватная фильтрация или отсутствие фильтрации используемого красителя.
Наличие морфологических артефактов
В мазках могут появляться морфологические артефакты, что затрудняет визуализацию и интерпретацию имеющихся структур. Это связано с:
- Тип используемого антикоагулянта, такой как гепарин.
- Использование грязных, поврежденных или жирных листов.
Режим хранения
После приготовления краситель должен храниться при комнатной температуре (15-25 ° C), чтобы предотвратить выпадение красителя. Хранить в закрытой янтарной таре.
ссылки
- Каннова Д., Брито Е. и Саймонс М. Оценка методов окрашивания для диагностики кожного лейшманиоза. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Реагенты. Гимза пятно. Версия 2: JMBJUL17 CEIVD10ES. Кастельяр-дель-Вальес, Испания.
- Clark G. Процедуры окрашивания (1981), 4thhed. Уильямс и Уиллкинс.
- Прикладная клиническая химия Краситель Гимза для диагностики в пробирке. Дистрибьютор: cromakit.es
- Рамирес I, Мехия М, Гарсия де ла Рива Дж, Гермес Ф и Грациозо С. Достоверность пятен Гимзы и Лендрума в конъюнктивальных мазках для идентификации Chlamydia trachomatis. Бол Санит Панам. 1994; 116 (3): 212-216.
- Касас-Ринкон Г. Общая микология. 1994. 2-е изд. Universidad Central de Venezuela, Библиотечное издание. Венесуэла, Каракас.
- "Гимза пятно." Википедия, Свободная энциклопедия. 1 сентября 2017, 01:02 UTC. 6 декабря 2018 г., en.wikipedia.org.


