Агаровая основа крови, использование и подготовка
кровяной агар это обогащенная твердая среда, дифференциальная, но не селективная. Он используется для восстановления и роста большого разнообразия микроорганизмов из клинических образцов или субкультур..
Классический кровяной агар должен быть включен для посева большинства клинических образцов, полученных в лаборатории; за исключением образцов кала, где это бесполезно, если только они не подготовлены с определенными модификациями.
Эта культуральная среда в основном состоит из обогащенного базового агара и 5% крови. Основа агара может варьироваться в зависимости от потребностей, но в основном будет состоять из пептонов, аминокислот, витаминов, мясного экстракта, хлорида натрия, агара и других..
Что касается крови, обычно требуется контакт с биотерием для получения крови от животных, таких как овцы, кролики или лошади. Однако это не всегда возможно, и иногда используется человеческая кровь.
Среда с кровяным агаром может быть приготовлена в лаборатории или приобретена для компаний, которые ей посвящены. Приготовление этой среды является одним из самых деликатных, любая небрежность при ее приготовлении приведет к загрязнению партии.
Вот почему должны быть приняты все возможные меры предосторожности, и, в конце концов, должен быть проведен контроль качества инкубирования при 37 ° С на 1 чашку на каждые 100 приготовленных.
индекс
- 1 фундамент
- 2 использования
- 2.1 Выбор группы крови
- 2.2 Выбор типа базового агара
- 2.3 Использование кровяного агара в соответствии с базовой средой, использованной для его приготовления
- 3 Подготовка
- 3.1 Взвешивать и растворять
- 3.2 Стерилизовать
- 3.3 Агрегация крови
- 3.4 Разлить в чашки Петри
- 4 Ссылки
фундамент
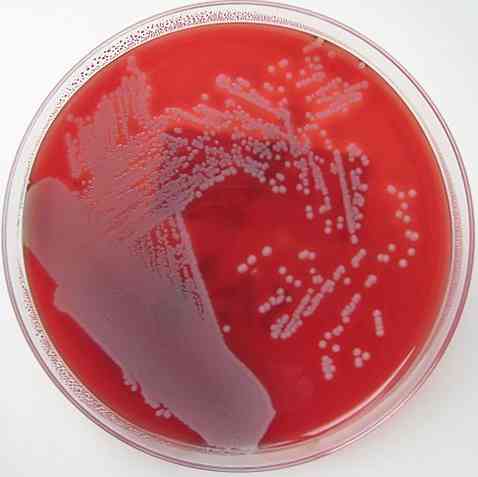 Уже упоминалось, что кровяной агар обладает характеристикой обогащенной, дифференцированной и неселективной среды. Основание каждого из этих свойств объясняется ниже.
Уже упоминалось, что кровяной агар обладает характеристикой обогащенной, дифференцированной и неселективной среды. Основание каждого из этих свойств объясняется ниже.
Кровяной агар является обогащенной средой, поскольку он содержит в качестве основной добавки 5-10% крови на основе агара. Оба соединения содержат много питательных веществ, и это свойство позволяет большинству пригодных для культивирования бактерий расти в нем..
Этот рост происходит без ограничений; по этой причине это неселективно. Однако, если в эту среду добавляются соединения, которые предотвращают рост некоторых микроорганизмов и способствуют росту других, он становится селективным. Это тот случай, если определенные типы антибиотиков или противогрибковых добавляются.
Точно так же кровяной агар является дифференциальной средой, поскольку он позволяет различать 3 типа бактерий: бета-гемолитические, альфа-гемолитические и гамма-гемолитические..
Бета-гемолитики - это те, которые обладают способностью лизировать или полностью разрушать эритроциты, образуя прозрачный ореол вокруг колоний, таким образом вызывая β или β гемолиз - гемолиз, а микроорганизмы называются β-гемолитическими..
Примерами ß-гемолитических бактерий являются Streptococcus pyogenes и Streptococcus agalactiae.
Альфа-гемолитики - это те, которые выполняют частичный гемолиз, где гемоглобин окисляется до метгемоглобина, создавая зеленоватую окраску вокруг колоний. Это явление известно как гемолиз α или α-гемолиз, а бактерии классифицируются как α-гемолитические..
Примером α-гемолитических бактерий являются Streptococcus pneumoniae и стрептококк группы viridans.
Наконец, существуют бактерии, называемые гамма-гемолитическими или негемолитическими. Они растут на агаре, не вызывая изменений на нем, эффект, известный как γ-гемолиз, а микроорганизмы являются γ-гемолитическими..
Пример γ-гемолитических бактерий: некоторые штаммы Streptococcus группы D (Streptococcus bovis и Enterococcus faecalis).
приложений
Культуральная среда с агаром крови является одной из наиболее часто используемых в лаборатории микробиологии..
Среди микроорганизмов, способных расти на агаризованной среде крови: строгие, факультативные, микроаэрофильные, анаэробные, грамположительные или грамотрицательные аэробные бактерии, быстрорастущие или медленнорастущие бактерии..
Некоторые бактерии, которые требуют или мешают с точки зрения питания, а также грибки и дрожжи, также растут. Аналогично, это полезно для субкультуры или реактивации штаммов, которые очень слабо метаболически.
Однако выбор типа крови и основного агара будет варьироваться в зависимости от вероятного микроорганизма, который подозревается в выздоровлении, и от использования бляшки (культура или антибиограмма)..
Выбор группы крови
Кровь может быть ягнёнком, кроликом, лошадью или человеком.
Наиболее рекомендуемой является кровь ягненка, за некоторыми исключениями. Например, для выделения видов Haemophilus, где рекомендуемой кровью является лошадь или кролик, поскольку в крови ягненка содержатся ферменты, которые ингибируют фактор V.
Наименее рекомендуемым является человек, однако он наиболее часто используется, возможно, потому, что его легче всего получить..
Кровь должна быть дефибринирована, получена без каких-либо добавок и от здоровых животных. Для использования человеческой крови необходимо учитывать несколько факторов:
Если кровь поступает от людей, перенесших бактериальные инфекции, у них будут специфические антитела. В этих условиях рост некоторых бактерий, вероятно, будет подавлен.
Если он получен из банка крови, он содержит цитрат, и возможно, что некоторые бактерии не развиваются в его присутствии. С другой стороны, если кровь поступает от пациентов, принимающих антибиотики, рост чувствительных бактерий может быть замедлен.
И если кровь от диабетика, избыток глюкозы мешает правильному развитию паттернов гемолиза..
Выбор типа базового агара
Базовый агар, используемый для приготовления кровяного агара, может быть очень широким. Среди них: питательный агар, агар для инфузии мозга, соевый агар с триптиказой, агар Müeller Hinton, агар Thayer Martin, агар Columbia, агар Brucella, агар Campylobacter и т. Д..
Использование кровяного агара в соответствии с базовой средой, используемой для его приготовления
Питательный агар
Эта база используется реже всего, потому что на ней будут расти в основном нетребовательные бактерии, такие как кишечные палочки, Pseudomonas sp, S. aureus, Bacillus sp., среди других. Не рекомендуется выделять стрептококк.
Инфузионный агар для сердца (BHI)
Он является одним из наиболее используемых в качестве основы кровяного агара, поскольку в нем содержатся необходимые питательные вещества для роста большинства бактерий, в том числе Streptococcus sp и другие требовательные бактерии. Хотя не следует соблюдать закономерности гемолиза.
Кровь ягненка обычно используется с этой основой.
Также могут быть приготовлены варианты с кровяным агаром, где добавляются другие соединения для выделения определенных микроорганизмов. Например, инфузионный агар мозга с добавлением кроличьей крови, цистина и глюкозы служит для выделения Francisella tularensis.
Принимая во внимание, что с цистином теллурит полезен для выделения Corynebacterium diphteriae. Вы можете использовать кровь человека или ягненка.
В первом случае бета-гемолиз будет выглядеть как узкое гало, а во втором гало будет гораздо шире.
Аналогично, эта основа вместе с бацитрацином, кукурузным крахмалом, лошадиной кровью и другими добавками для обогащения (IsoVitaleX), используется для выделения рода Haemophilus sp из дыхательных проб.
Кроме того, если вы добавляете комбинацию антибиотиков хлорамфеникол - гентамицин или пенициллин - стрептомицин с лошадиной кровью, это идеально подходит для выделения требовательных патогенных грибов, даже с более высоким выходом, чем глюкозный агар Сабура. Это особенно полезно в изоляции Histoplasma capsulatum.
Триптивная соя
Эта база является наиболее рекомендуемой для лучшего наблюдения за характером гемолиза и выполнения диагностических тестов, таких как таксоны оптохина и бацитрацина. Это классический кровяной агар, который обычно используется.
С помощью этой базы вы также можете приготовить специальный кровяной агар для Corynebacterium diphteriae, с теллур цистином и кровь ягненка.
Аналогично, комбинация этого агара с кровью ягненка плюс канамицин-ванкомицин идеальна для роста анаэробов, особенно Bacteroides sp.
Агар Мюллер Хинтон
Эта основа с добавлением крови используется для выполнения антибиограммы требовательных микроорганизмов, таких как Streptococcus sp.
Это также полезно для выделения таких бактерий, как Legionella pneumophila.
Агар Тайер Мартин
Эта среда идеально подходит в качестве основы для кровяного агара, когда подозревается род Neisseria, особенно Neisseria meningitidis, в качестве N. gonorrhoeae не растет на кровяном агаре.
Он также служит для проведения тестов на чувствительность к Neisseria meningitidis.
Агар Колумбия
Эта база отлично подходит для посева образцов желудочной биопсии в поисках Helicobacter pylori.
Среду готовят путем добавления 7% крови ягненка, дефибринированной антибиотиками (ванкомицин, триметоприм, амфотерицин В и цефсулодин), чтобы ограничить рост других типов бактерий, которые могут присутствовать.
Эта же основа с добавлением крови человека или ягненка, налидиксовой кислоты и колистина полезна для выделения Gardnerella vaginalis. Он также идеально подходит для оценки чувствительности к антимикробным препаратам к антибиотикам того же микроорганизма..
Кроме того, он используется для приготовления кровяного агара для выращивания анаэробов, добавления аминогликозидов и ванкомицина.
Эта база позволяет нам правильно наблюдать закономерности гемолиза.
Бруцелла Агар
Эта среда, используемая в качестве основы кровяного агара вместе с добавлением витамина К, идеально подходит для выращивания анаэробных бактерий. В этом случае рекомендуется использовать кровь ягненка.
Кампилобактер агар
Агар Кампилобактер, дополненный 5% овечьей крови и 5 антибиотиками (цефалотин, амфотерицин В, триметоприм, полимиксин В и ванкомицин), является средой, используемой для выделения Campylobacter jejuni в образцах стула.
подготовка
Каждый коммерческий дом несет на обратной стороне упаковки инструкции по приготовлению литра питательной среды. Соответствующие расчеты могут быть сделаны для приготовления желаемого количества, в соответствии с выбранным базовым агаром.
Взвесьте и растворите
Базовый агар поставляется обезвоженным (порошок), поэтому его необходимо растворить в дистиллированной воде, доведенной до pH 7,3.
Количество, указанное выбранным базовым агаром, взвешивают и растворяют в соответствующем количестве воды в фиоле, затем нагревают до умеренного нагрева и перемешивают вращательными движениями до тех пор, пока весь порошок не растворится..
стерилизовать
После растворения стерилизовать в автоклаве при 121 ° С в течение 20 минут..
Агрегат крови
Покидая автоклав, дайте фиоле остыть, пока температура не будет колебаться между 40 и 50 ° C; температура, которую поддерживает человеческая кожа, и в то же время агар еще не затвердел.
Для этого к фиолле прикасаются рукой, и если тепло терпимо, это идеальная температура для добавления соответствующего количества дефибринированной крови (50 мл на литр агара). Аккуратно перемешать до гомогенизации.
Прохождение скопления крови имеет решающее значение, потому что, если это происходит, когда среда очень горячая, красные кровяные клетки будут разрушаться, и среда не будет служить для наблюдения гемолиза..
Если его добавить слишком холодным, образуются комочки, и поверхность среды не будет гладкой, чтобы сделать флейту правильно.
Разлить в чашки Петри
Подавать в стерильных чашках Петри сразу после гомогенизации крови. Приблизительно 20 мл наливают в каждую чашку Петри. Эта процедура выполняется в вытяжном шкафу или рядом с горелкой..
При подаче кровяного агара в чашки Петри на поверхности тарелки не должно оставаться пузырьков воздуха. Если это происходит, пламя горелки Бунзена быстро проходит над пластиной, чтобы устранить их..
Пластинам дают затвердеть и хранят в холодильнике (2-8 ° С) в перевернутом виде до использования. Перед использованием кровяного агара пластины следует закалить (дать им принять комнатную температуру) для посева.
Готовые тарелки длятся примерно 1 неделю.
ссылки
- Байона М. Микробиологические условия выращивания Helicobacter pylori. Rev Col Гастроэнтерол 2013; 28 (2): 94-99
- Гарсия П., Паредес Ф., Фернандес дель Баррио М. (1994). Практическая клиническая микробиология. Университет Кадиса, 2-е издание. Издательская служба УЦА.
- «Агаровая кровь». Википедия, Свободная энциклопедия. 10 декабря 2018 года, 14:55 UTC. 27 декабря 2018, 01: 49 en.wikipedia.org.
- Forbes B, Sahm D, Weissfeld A. (2009). Микробиологическая диагностика Бэйли и Скотта. 12 изд. Аргентина. Panamericana S.A Редакция.
- СЕДИВЕТ Лаборатория ветеринарно-диагностического центра. Гватемала. Доступно по адресу: trensa.com.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Микробиологический диагноз. (5-е изд.). Аргентина, редакция Panamericana S.A..


