Характеристика атома углерода, структура, гибридизация, классификация
атом углерода Это, пожалуй, самый важный и символический из всех элементов, потому что благодаря этому возможно существование жизни. Он включает в себя не только несколько электронов или ядро с протонами и нейтронами, но и звездную пыль, которая в конечном итоге включается и образует живые существа.
Кроме того, атомы углерода находятся в земной коре, хотя их количество не сопоставимо с такими металлическими элементами, как железо, карбонаты, диоксид углерода, нефть, алмазы, углеводы и т. Д., Которые являются частью его физические и химические проявления.
Но как атом углерода? Первым неточным эскизом является тот, который наблюдается на изображении выше, характеристики которого описаны в следующем разделе..
Атомы углерода путешествуют через атмосферу, моря, недра, растения и любые виды животных. Его большое химическое разнообразие обусловлено высокой стабильностью его связей и тем, как они упорядочены в пространстве. Таким образом, он имеет с одной стороны гладкий и смазывающий графит; а с другой стороны, алмаз, твердость которого превосходит твердость многих материалов.
Если бы атом углерода не обладал качествами, которые его характеризуют, органическая химия не существовала бы полностью. Некоторые провидцы видят в нем новые материалы будущего через конструирование и функционализацию его аллотропных структур (углеродные нанотрубки, графен, фуллерены и т. Д.).
индекс
- 1 Характеристика атома углерода
- 2 Структура
- 3 Гибридизация
- 3.1 sp3
- 3.2 sp2 и sp
- 4 Классификация
- 4.1 Первичный
- 4.2 Вторичный
- 4.3 третичный
- 4.4 Четвертичный
- 5 использует
- 5.1 Атомная единица массы
- 5.2 Углеродный цикл и жизнь
- 5.3 13C ЯМР спектроскопия
- 6 Ссылки
Характеристики атома углерода
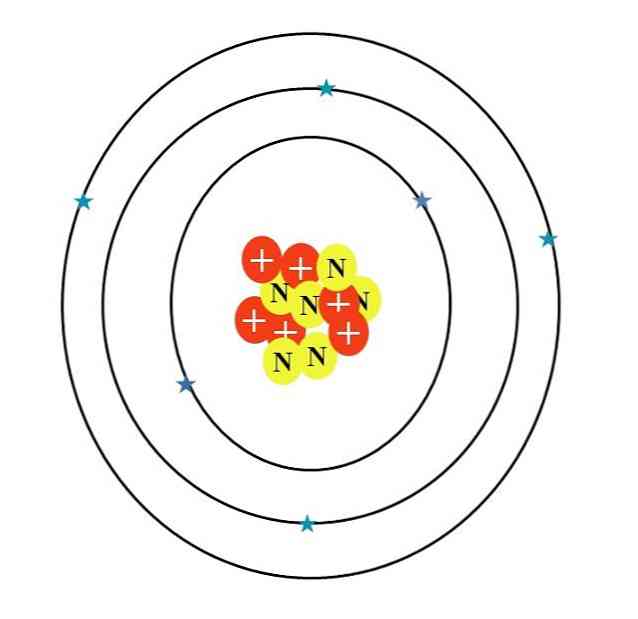
Атом углерода обозначается буквой C. Его атомный номер Z равен 6, следовательно, он имеет шесть протонов (красные кружки с символом «+» в ядре). Кроме того, он имеет шесть нейтронов (желтые кружки с буквой «N») и, наконец, шесть электронов (голубые звезды).
Сумма масс их атомных частиц дает среднее значение 12.0107 ед. Однако атом на изображении соответствует 12-изотопу углерода (12В), который состоит из д. Другие изотопы, такие как 13С и 14С, менее обильные, изменяются только по числу нейтронов.
Итак, если вы рисуете эти изотопы на 13C будет иметь дополнительный желтый круг, а 14С, еще два. Это логически означает, что они являются более тяжелыми атомами углерода.
В дополнение к этому, какие еще характеристики могут быть упомянуты в этом отношении? Он четырехвалентен, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (НДС) периодической таблицы, более конкретно в блоке p.
Это также очень универсальный атом, способный связывать практически все элементы периодической таблицы; особенно с самим собой, образуя макромолекулы и линейные, разветвленные и пластинчатые полимеры.
структура
Какова структура атома углерода? Чтобы ответить на этот вопрос, сначала вы должны перейти к вашей электронной конфигурации: 1с22s22р2 или [Он] 2с22р2.
Таким образом, есть три орбитали: 12, 2s2 и 2р2, каждый с двумя электронами. Это также можно увидеть на изображении выше: три кольца с двумя электронами (голубые звезды) каждое (не путайте кольца с орбитами: они орбитальные).
Обратите внимание, однако, что две звезды имеют более темный оттенок синего цвета, чем остальные четыре. Почему? Потому что первые два соответствуют внутреннему слою 1с2 или [He], который не участвует непосредственно в образовании химических связей; в то время как электроны во внешнем слое, 2s и 2p, делают.
S и p орбитали не имеют одинаковую форму, поэтому проиллюстрированный атом не соответствует действительности; в дополнение к большой диспропорции расстояния между электронами и ядром, которое должно быть в сотни раз больше.
Поэтому структура атома углерода состоит из трех орбиталей, где электроны «тают» в рассеянные электронные облака. И между ядром и этими электронами есть расстояние, которое позволяет нам увидеть огромную «пустоту» внутри атома.
гибридизация
Ранее упоминалось, что атом углерода является четырехвалентным. В соответствии с его электронной конфигурацией его 2s-электроны спарены, а 2p-электроны спарены:
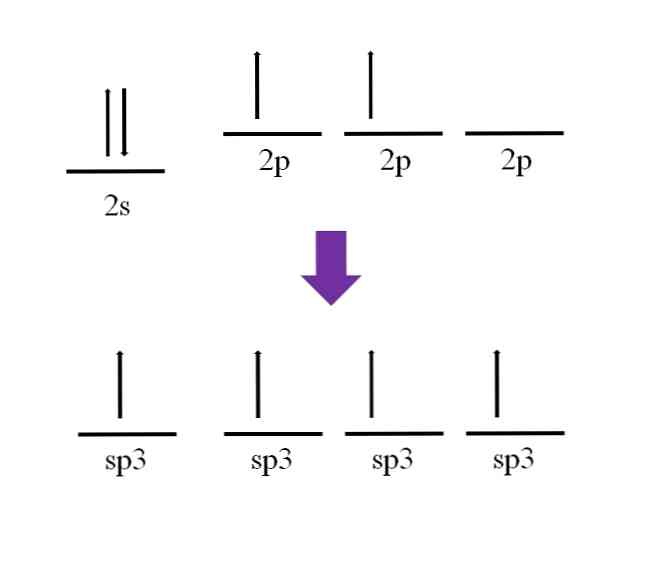
Остается свободная орбиталь, которая пуста и заполнена дополнительным электроном в атоме азота (2р3).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для своего образования; Тем не менее, можно заметить, что в базальное состояние атома углерода, он едва имеет два неспаренных электрона (по одному в каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, и, следовательно, он образует только две связи (-C-).
Итак, как это возможно, что атом углерода образует четыре связи? Для этого вы должны продвинуть электрон с орбитали 2s на орбиту с более высокой энергией 2p. Это сделано, четыре получающиеся орбитали вырождаться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены).
Этот процесс известен как гибридизация, и благодаря этому теперь атом углерода имеет четыре орбитальных sp3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с тем, что он является четырехвалентным.
зр3
Когда атом углерода обладает sp-гибридизацией3, Ориентируйте его четыре гибридные орбитали к вершинам тетраэдра, который является его электронной геометрией.
Таким образом, вы можете определить углеродный сп3 потому что он образует только четыре простые связи, как в молекуле метана (СН4). И вокруг этого можно наблюдать тетраэдрическую среду.
Перекрытие sp орбиталей3 она настолько эффективна и стабильна, что простая связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные углеродистые структуры и неизмеримое количество органических соединений. В дополнение к этому, атомы углерода могут образовывать другие типы связей.
зр2 и зр
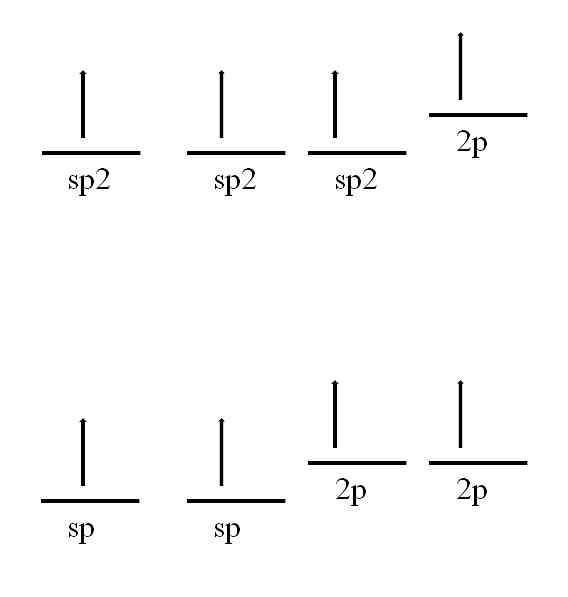
Атом углерода также способен принимать другие гибридизации, которые позволят ему образовывать двойную или даже тройную связь.
В sp гибридизации2, Как видно на изображении, есть три sp-орбитали2 вырождается и 2p орбиталь остается неизменной или "чистой". С тремя орбитали2 отделенный на 120º, углерод образует три ковалентные связи, рисуя электронную геометрию в треугольной плоскости; в то время как с 2p-орбиталью, перпендикулярной остальным трем, она образует связь π: -C = C-.
Для случая sp-гибридизации есть две sp-орбитали, разделенные на 180º, так что они рисуют линейную электронную геометрию. На этот раз они имеют две чистые 2p-орбитали, перпендикулярные друг другу, которые позволяют углероду образовывать тройные связи или две двойные связи: -C≡C- или ... C = C = C ... (центральный углерод имеет sp-гибридизацию) ).
Обратите внимание, что всегда (обычно), если вы добавите ссылки вокруг углерода, вы обнаружите, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур. Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
классификация
Как классифицируются атомы углерода? Больше, чем классификация по внутренним характеристикам, в действительности это зависит от молекулярной среды. То есть, что внутри молекулы ее атомы углерода могут быть классифицированы в соответствии со следующим.
первичный
Первичный углерод - это тот, который связан только с другим углеродом. Например, молекула этана, СН3-СН3 состоит из двух связанных первичных углеродов. Это сигнализирует о конце или начале углеродной цепи.
вторичный
Это тот, который связан с двумя атомами углерода. Итак, для молекулы пропана, СН3-СН2-СН3, атом углерода среды является вторичным (метиленовая группа, -CH2-).
третичный
Третичные атомы углерода отличаются от остальных тем, что из них возникают ветви основной цепи. Например, 2-метилбутан (также называемый изопентан), СН3-СН(СН3) -CH2-СН3 Третичный углерод выделен жирным шрифтом.
четвертичный
И, наконец, четвертичные атомы углерода, как следует из названия, связаны с четырьмя другими атомами углерода. Молекула неопентана, С(СН3)4 имеет четвертичный атом углерода.
приложений
Атомная единица массы
Средняя атомная масса 12C используется в качестве стандартной меры для расчета массы других элементов. Таким образом, водород весит двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как атомная единица массы u.
Таким образом, другие атомные массы можно сравнить с 12С а 1H. Например, магний (24Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают СО2 в процессе фотосинтеза выделяют кислород в атмосферу и действуют как легкие растений. Когда они умирают, они становятся древесным углем, который после сжигания выделяет СО2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая многие микроорганизмы.
Когда микроорганизмы умирают, оставшиеся твердые в его осадок биологического разложения, и через миллионы лет, он превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии для сжигания угля, оно способствует выделению большего количества СО2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода из самых глубоких ее основ. Это происходит из-за стабильности его связей, что позволяет ему формировать цепочки и молекулярные структуры, которые составляют макромолекулы, столь же важные, как ДНК.
ЯМР спектроскопия 13С
13С, даже если он в гораздо меньшей пропорции, чем 12С его обилие достаточно, чтобы выяснить молекулярные структуры с помощью ядерной магнитно-резонансной спектроскопии углерода-13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13С и к каким функциональным группам они относятся. Таким образом, углеродный скелет любого органического соединения может быть определен.
ссылки
- Грэм Соломонс Т.В., Крейг Б. Фрайл. Органическая химия. Амины. (10-е издание.) Wiley Plus.
- Блейк Д. (4 мая 2018 г.). Четыре характеристики углерода. Получено от: sciencing.com
- Королевское химическое общество. (2018). Carbon. Взято с: rsc.org
- Понимание эволюции. (Н.Д.). Путешествие атома углерода. Получено от: evolution.berkeley.edu
- Энциклопедия Британника. (14 марта 2018 г.) Carbon. Получено с: britannica.com
- Паппас С. (29 сентября 2017 г.). Факты о углероде. Получено с: livescience.com


