Сульфид натрия Формулы, использование, риски
сульфид натрия (Na2S) представляет собой кристаллическое твердое вещество от желтого до кирпично-красного. В природе встречается с разной степенью гидратации, являясь наиболее распространенным нонагидратом сульфида натрия (Na2S · 9H2O)..
Это водорастворимые соли, которые дают сильно щелочные растворы. При воздействии влажного воздуха они поглощают влагу из воздуха, которая может самопроизвольно нагреваться и вызывать воспламенение близлежащих горючих материалов. Кроме того, при контакте с влажным воздухом они выделяют сероводород, который пахнет тухлыми яйцами.

Они являются сильными восстановителями. Эти вещества могут быть опасны для окружающей среды, особенно для водных организмов..
Моносульфид натрия коммерчески доступен в форме хлопьев, содержащих 60-62% Na2С ...
- формулы

- CAS: 1313-82-2 Сульфид натрия (безводный)
- CAS: 1313-84-4 Сульфид натрия (неагидратированный)
2D структура
3D структура
Характеристика сульфида натрия
Физико-химические свойства

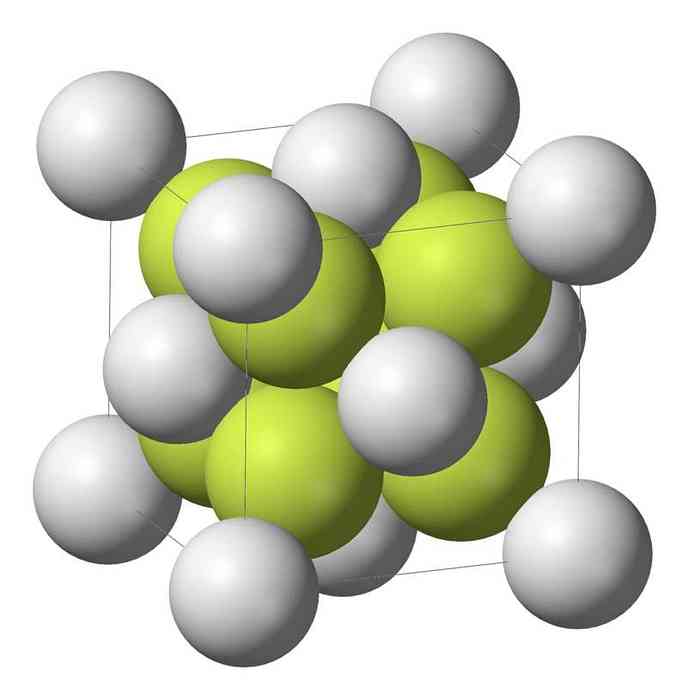
Моносульфид натрия (Na2S) кристаллизуется с антифторитовой структурой, в которой каждый атом S окружен кубом из 8 атомов Na, а каждый атом Na - тетраэдром из 4 атомов S..
воспламеняемость
Единственным легко воспламеняющимся веществом в группе неорганических сульфидов является сероводород. Однако некоторые другие неорганические сульфиды, такие как сульфид натрия, могут самопроизвольно нагреваться и даже воспламеняться при воздействии влаги..
При воздействии огня сульфид натрия выделяет газы или пары диоксида серы, которые являются раздражающими или токсичными.
реактивность
- Неорганические сульфиды обычно являются основными (некоторые являются сильно основными и поэтому несовместимы с кислотами).
- Многие из этих соединений являются восстановителями (они энергично реагируют с окислителями).
- Простые соли сульфидов (такие как сульфид натрия, калия и аммония) активно реагируют с кислотами с выделением высокотоксичного и легковоспламеняющегося газообразного сероводорода.
- Сульфид натрия легко воспламеняется. Может взорваться при быстром нагревании или ударе.
- При нагревании до разложения выделяет токсичные пары оксида натрия и оксидов серы..
- Реагирует бурно с углеродом, углем, солями диазония, N, N-дихлорметиламином, сильными окислителями и водой.
токсичность
Многие представители группы неорганических сульфидов ведут себя как сильные основания и могут вызвать сильные ожоги при контакте с кожей..
Это свойство зависит от его растворимости. Наиболее нерастворимые неорганические сульфиды (например, сульфид ртути (II) и сульфид кадмия) не являются едкими.
Сульфид натрия имеет средний коэффициент распределения октанол / вода (Pow) (-3,5). Эта величина используется как мера растворимости (и биоконцентрации) вещества в жировых тканях животных (особенно водных животных)..
Сульфид натрия считается опасным для окружающей среды, особенно для водных организмов..
приложений
В домашних условиях сульфида натрия используют для разглаживания труб, бытовых чистящих средств (для печи, ванной комнаты), выпрямителей для волос, мыла для посуды и автомобильных подушек безопасности..
В промышленности его используют в очистителях, в цементе и в качестве прекурсора при производстве других химических продуктов..
Клинические эффекты
Воздействие сульфида натрия распространено в развитых и слаборазвитых странах, как в промышленности, так и дома. Эти едкие вещества присутствуют в нескольких бытовых продуктах в низких концентрациях.
В развитых странах серьезные последствия редки. Это происходит главным образом из-за преднамеренного приема химического вещества у взрослых. Однако в развивающихся странах серьезные последствия встречаются чаще..
Щелочные коррозийные вещества вызывают некроз из-за разжижения. Омылять жиры в клеточной мембране, разрушая клетки и обеспечивая глубокое проникновение в ткани слизистых оболочек.
Устное воздействие
Первичное воспаление происходит в желудочно-кишечной ткани, затем следует некроз ткани (с возможной перфорацией), затем грануляция и, наконец, формирование стеноза..
У пациентов с легким проглатыванием развиваются раздражение или ожоги I степени (поверхностная гиперемия и отек) ротоглотки, пищевода или желудка.
У пациентов с умеренной интоксикацией могут развиться ожоги II степени (поверхностные волдыри, эрозии и изъязвления) с возможным дальнейшим формированием стеноза (особенно пищевода).
У некоторых пациентов (особенно маленьких детей) может развиться отек в верхних дыхательных путях.
У пациентов с тяжелой интоксикацией при проглатывании могут развиться глубокие ожоги и некроз слизистой оболочки желудочно-кишечного тракта с такими осложнениями, как перфорация (пищевод, желудок, редко двенадцатиперстная кишка), образование свищей (трахеопищевод, аортоэзофаге) и желудочно-кишечное кровоизлияние.
Они могут развиться: гипотензия, тахикардия, тахипноэ, образование стриктур (в основном пищевода), рак пищевода и отек верхних дыхательных путей (что является распространенным и часто опасным для жизни).
Сильное отравление, как правило, ограничивается преднамеренным потреблением у взрослых.
Воздействие при вдыхании
Легкое воздействие может вызвать кашель и бронхоспазм.
Тяжелое вдыхание может вызвать отек верхних дыхательных путей, ожоги, стридор и, редко, острое повреждение легких.
Воздействие на глаза
Это может привести к сильному раздражению конъюнктивы и хемозу, дефектам эпителия роговицы, лимбической ишемии, постоянной потере зрения и в тяжелых случаях перфорации..
Кожное воздействие
Мягкое воздействие вызывает раздражение и частичные ожоги. Метаболический ацидоз может развиться у пациентов с тяжелыми ожогами или шоком.
Длительное воздействие или продукты с высокой концентрацией могут вызвать ожоги общей толщины.
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA)
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и предназначенную для замены различных стандартов классификации и маркировки, используемых в разных странах, с использованием согласованных критериев во всем мире..
Классы опасности (и соответствующая им глава СГС), стандарты классификации и маркировки, а также рекомендации для сульфида натрия следующие (Европейское химическое агентство, 2017, Организация Объединенных Наций, 2015, PubChem, 2017):







ссылки
- Benjah-bmm27, (2006). Флюорит-элемент-клетка-3D-ионная [изображение] Получено с: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [изображение] Источник: chem.nlm.nih.gov.
- ChemIDplus, (2017). Трехмерная структура 1313-82-2 - сульфид натрия [изображение] Получено из: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D структура 1313-84-4 - сульфид натрия [изображение] Получено из: chem.nlm.nih.gov.
- Европейское химическое агентство (ECHA). (2017). Краткое описание классификации и маркировки.
- Согласованная классификация - Приложение VI к Регламенту (ЕС) № 1272/2008 (Регламент CLP). Сульфид натрия. Получено 16 января 2017 г. с сайта echa.europa.eu.
- Европейское химическое агентство (ECHA). (2017). Краткое описание классификации и маркировки.
- Уведомленная классификация и маркировка. Сульфид натрия, гидратированный. Получено 16 января 2017 г. с сайта echa.europa.eu.
- Банк данных по опасным веществам (HSDB). TOXNET. (2017). Сульфид натрия. Bethesda, MD, EU: Национальная медицинская библиотека. Получено от: toxnet.nlm.nih.gov.
- Lange L. & Triebel W. (2000). Сульфиды, полисульфиды и сульфаны. В энциклопедии промышленной химии Ульмана. Wiley-VCH Verlag GmbH & Co. KGaA. Получено с dx.doi.org.
- Организация Объединенных Наций (2015). Согласованная на глобальном уровне система классификации и маркировки химических продуктов (SGA), шестое пересмотренное издание. Нью-Йорк, США: издание Организации Объединенных Наций. Получено от: unece.org.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2016). Эннеагидрат сульфида натрия - структура PubChem [изображение] Получено с: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2017). Моносульфид натрия. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2017). Эннеагидрат сульфида натрия. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальное управление океанических и атмосферных исследований (NOAA). CAMEO Химические вещества. (2017). Химический паспорт. Сульфид натрия, безводный. Серебряная весна, MD. ЕС; Получено от: cameochemicals.noaa.gov.
- Национальное управление океанических и атмосферных исследований (NOAA). CAMEO Химические вещества. (2017). Reactive Group Datasheet. Сульфиды неорганические. Серебряная весна, MD. ЕС; Получено от: cameochemicals.noaa.gov.
- Ондржей Мангл, (2007). Sulfid sodný - Na2S [изображение] Получено с: wikipedia.org.
- ПабХим, (2016). Моносульфид натрия [изображение] Получено от: puchem.nlm.nih.gov.
- ПабХим, (2016). Эннеагидрат сульфида натрия [изображение] Источник: puchem.nlm.nih.gov.
- Wikipedia. (2017). Коэффициент распределения октанол-вода. Получено 17 января 2017 г., из: wikipedia.org.
- Wikipedia. (2017). Сульфид натрия. Получено 17 января 2017 г., из: wikipedia.org.


