Сульфат натрия Формула, свойства, структура, применение
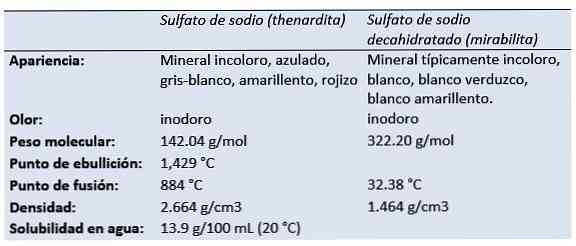
сульфат натрия (динатриевая соль серной кислоты, динатриевый тетраоксидосульфат, сульфат соды, соль глаубера, тенардит, мирабилит) - неорганическое соединение с формулой Na2SW4 и связанные с ним гидраты. Все формы представляют собой белые твердые вещества, которые хорошо растворяются в воде..
Он считается одним из основных продаваемых химических продуктов. Его мировое производство (почти исключительно в форме декагидрата) составляет около 6 миллионов тонн в год..

Теноардит - это безводный минерал сульфата натрия, который добывается в аридных средах эвапоритов, в сухих пещерах, на старых горных работах в виде выцветания и в виде осадка вокруг фумарол..
Впервые он был описан в 1825 году в Салинас-Эспартинас (Сьемпосуэлос, Мадрид, Испания) и был назван тенардита в честь французского химика Луи Жака Тенара (1777-1826)..

Голландский / немецкий химик и аптекарь Иоганн Рудольф Глаубер (1604-1670) обнаружил в 1625 году в воде австрийского источника декагидрат сульфата натрия (позже известный как соль Глаубера). Он назвал это солью mirabilis (чудодейственная соль), из-за ее целебных свойств.
Между 1650 и 1660 годами Глаубер начал производить сульфат натрия из поваренной соли (NaCl) и концентрированной серной кислоты. Этот процесс считается началом химической промышленности.
Его кристаллы использовались в качестве слабительного до 20-го века.
В восемнадцатом веке реакция глауберова соли с калием (карбонат калия) начала использоваться в промышленном производстве кальцинированной соды (карбонат натрия)..

В настоящее время он используется в основном для производства моющих средств и в процессе крафт-производства бумажной массы (доминирующий метод в производстве бумаги).
Месторождения сульфата натрия находятся в Соединенных Штатах, Канаде, Испании, Италии, Турции, Румынии, Мексике, Ботсване, Китае, Египте, Монголии и Южной Африке..
Основными производителями являются Китай (провинции Цзянсу и Сычуань), за которым следует Испания, где находится крупнейшее в мире месторождение глауберита (в Сересо-де-Рио-Тирон, Бургос)..
Общее мировое производство природного сульфата натрия оценивается примерно в 8 миллионов тонн, а это как побочный продукт других промышленных процессов от 2 до 4 млн. Тонн..
В Испании, согласно информации, опубликованной в Национальной инвентаризации ресурсов сульфата натрия, и другим обновленным данным, оценочные запасы минералов сульфата натрия порядка 730 млн. Тонн занесены в каталог как «запасы», а еще 300 млн. Тонн внесены в каталог «прочие ресурсы»..
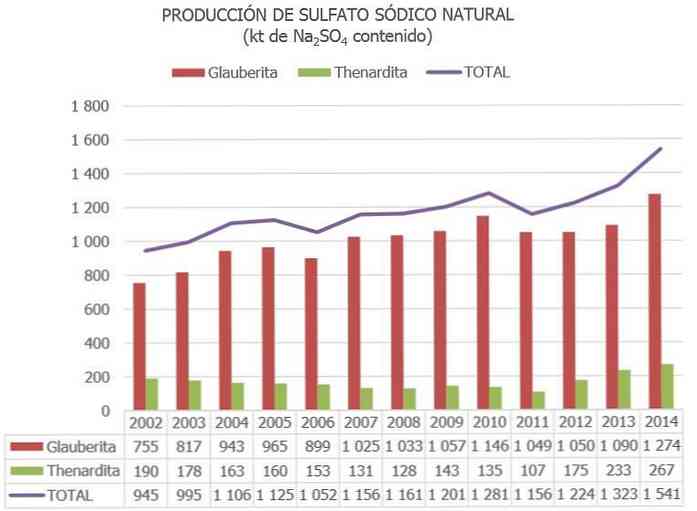
В Европейском Союзе Испания в настоящее время является единственной страной с рудами сульфата натрия (главным образом, терардита, глауберита и мирабилита)..
В настоящее время наблюдается общее снижение спроса на сульфат натрия в текстильной промышленности..
В последние годы в некоторых регионах, таких как моющие средства, наблюдается некоторый рост в связи с их низкой ценой в качестве сырья..
Основные расширяющиеся рынки моющих средств на основе сульфата натрия находятся в Азии, Центральной Америке и Южной Америке..
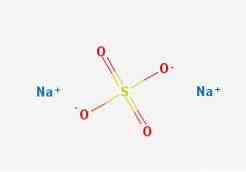
формулы

2D структура
3D структура
черты
Физико-химические свойства
Сульфат натрия относится к реакционноспособной группе соединений натрия, а также к группе сульфатов, гидросульфатов и дисульфитов..
воспламеняемость
Это негорючее вещество. Нет риска взрыва его порошков.
реактивность
Сульфат натрия очень хорошо растворяется в воде и гигроскопичен. Он очень стабилен, не реагирует на большинство окислителей или восстановителей при нормальных температурах. При высоких температурах его можно превратить в сульфид натрия путем карботермического восстановления..
Химически нереакционноспособные вещества считаются нереакционноспособными в типичных условиях окружающей среды (хотя они могут вступать в реакцию при относительно экстремальных условиях или при катализе). Они устойчивы к окислению и восстановлению (кроме экстремальных условий).
Опасные химические реакции
Когда алюминий плавится вместе с сульфатом натрия или калия, происходит сильный взрыв.
токсичность
Химически нереактивные вещества считаются нетоксичными (хотя газообразные вещества из этой группы могут действовать как удушающие вещества).
Хотя сульфат натрия обычно считается нетоксичным, с ним следует обращаться осторожно. Порошок может вызвать астму или временное раздражение глаз. Этого риска можно избежать, надев защитные очки и бумажную маску.
приложений
Основные области его применения: производство
- стиральный порошок.
- бумажная масса.
- текстиль.
- стекло.
- синтез ферментов (виноделие).
- пища для человека и животных.
- аптечная продукция.
- базовая химия в целом.
- стальные процессы.
- Стиральный порошок
Сульфат натрия - очень дешевый материал. Его наибольшее использование в качестве наполнителя в бытовых порошковых моющих средствах, потребляя ок. 50% мирового производства. Новые компактные или жидкие моющие средства не содержат сульфат натрия, поэтому это использование уменьшается.
Другое использование сульфата натрия, значение которого уменьшается, особенно в США. и Канада, в процессе крафт-производства для производства древесной массы. Достижения в области термической эффективности процесса резко сократили потребность в сульфате натрия.
Стекольная промышленность обеспечивает еще одно важное применение для сульфата натрия. Это второе по величине приложение в Европе. Сульфат натрия используется для устранения небольших пузырьков воздуха из расплавленного стекла.
В Японии самое большое применение сульфата натрия в производстве текстиля. Сульфат натрия помогает красителям равномерно проникать в волокна и не разъедает сосуды из нержавеющей стали, используемые при крашении (в отличие от хлорида натрия, который является альтернативным методом).
Сульфат натрия особенно подходит для хранения солнечного тепла низкого качества (для последующего выделения при нагревании) из-за его высокой теплоемкости при переходе фазы от твердого к жидкому, которое дается при 32 ° C.
При охлаждении смесь с поваренной солью хлорида натрия (NaCl) снижает температуру плавления до 18 ° C..
В лаборатории безводный сульфат натрия широко используется в качестве инертного осушителя для удаления следов воды из органических растворов. Его действие медленнее, чем у сульфата магния, но его можно использовать с различными материалами, поскольку он химически довольно инертен.
В качестве слабительного средства исторически использовался декагидрат сульфата натрия (глауберова соль). Он эффективен для устранения определенных препаратов, таких как ацетаминофен (acetaminophen), из организма после передозировки..
Другие области применения сульфата натрия включают его использование в качестве добавки при изготовлении освежителей воздуха для ковров, в качестве добавки в корм для скота и в производстве крахмала..
Клинические эффекты
По своему терапевтическому применению сульфат натрия относится к категории солевых и слабительных слабительных средств, используемых при лечении запоров..
Солевые катаракты - это соли, которые удерживают жидкости в кишечнике за счет осмотического действия неабсорбированной соли, косвенно увеличивая перистальтику.
Катализаторы в солевом растворе плохо всасываются желудочно-кишечным трактом, поэтому системная токсичность маловероятна, если не поступить в организм в больших количествах. Тем не менее, большое воздействие может вызвать дегидратацию и электролитные изменения, вторичные к осмотическим эффектам соединения..
Хроническое злоупотребление слабительным может иметь место у пациентов с расстройствами пищевого поведения, синдромом Мюнхгаузена или искусственными расстройствами. В целом, пациенты испытывают тошноту, рвоту и диарею, связанные со спазмами в животе. Тяжелые последствия могут включать обезвоживание, гипотензию, гипернатриемию и нарушения электролитного баланса..
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA).
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и призванную заменить различные стандарты классификации и маркировки, используемые в разных странах, путем использования согласованных глобальных критериев (Организация Объединенных Наций). United, 2015).
Классы опасности (и соответствующая им глава СГС), стандарты классификации и маркировки и рекомендации по сульфату натрия являются следующими (Европейское химическое агентство, 2017, Организация Объединенных Наций, 2015, PubChem, 2017):
Классы опасности СГС
H315: вызывает раздражение кожи [Осторожно, коррозия / раздражение кожи - Категория 2].
H317: Может вызывать аллергическую кожную реакцию [Предупреждение Сенсибилизация, Кожа - Категория 1].
H319: Вызывает серьезное раздражение глаз [Предупреждение. Серьезное повреждение / раздражение глаз - Категория 2A].
H412: Вредно для водных организмов с долгосрочными неблагоприятными воздействиями [Опасно для водной среды, долгосрочная опасность - Категория 3].
(ПабХим, 2017)
Коды пруденциальных советов
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 и P501.
ссылки
- ChemIDplus (2017) 3D структура 7757-82-6 - безводный сульфат натрия [изображение]. Получено от: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D структура 7727-73-3 - сульфат натрия [USP] [изображение]. Получено от: chem.nlm.nih.gov.
- Dyet, D. (2007) Теноардит Сульфат натрия возле Содавилль Минерал, штат Невада [изображение] Источник: en.wikipedia.org.
- Европейское химическое агентство (ECHA), (2017). Краткое изложение классификации и маркировки. Согласованная классификация - Приложение VI к Регламенту (ЕС) № 1272/2008 (Регламент CLP). Сульфат натрия.
- Grumetisho (2012) Мирабилита [изображение] Получено с: es.wikipedia.org.
- Банк данных по опасным веществам (HSDB). TOXNET. (2017). Сульфат натрия Bethesda, MD, EU: Национальная медицинская библиотека. Получено от: toxnet.nlm.nih.gov.
- Геологический и горный институт Испании (IGME) (2016). ГЛАУБЕРИТА-ТЕНАРДИТА (НАТУРАЛЬНЫЙ СУЛЬФАТ НАТРИЯ) 2014. Горная панорама. Получено от: igme.es.
- Национальный институт безопасности труда (INSHT). (2010). Международная безопасность химической документации. Сульфат натрия. Министерство занятости и безопасности. Мадрид. Это. Получено с: insht.es.
- Восстание Лангбейна (2008 г.) Мельница из крафт-целлюлозы непрерывного действия [изображение] Получено с: wikimedia.org.
- Организация Объединенных Наций (2015). Согласованная на глобальном уровне система классификации и маркировки химических продуктов (SGA), шестое пересмотренное издание. Нью-Йорк, США: издание Организации Объединенных Наций. Получено от: unece.org.
- Национальный центр биотехнологической информации. База данных PubChem Compound (2016) сульфат натрия - Структура PubChem [изображение] Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound (2016) сульфат натрия - Структура PubChem [изображение] Bethesda, MD, EU: Национальная медицинская библиотека.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2017). Сульфат натрия декагидратированный. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2017). Сульфат натрия Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Сульфат натрия [изображение] Получено с: wikimedia.org.
- Википедия (2017) Крафт процесс. Получено с: wikipedia.org.
- Википедия (2017) Мирабилита. Получено с: wikipedia.org.
- Википедия (2017) Мирабилите. Получено с: wikipedia.org.
- Википедия (2017) Сульфат натрия. Получено с: wikipedia.org.
- Википедия (2017) Сульфато ди декадрат натрия. Получено с: https://it.wikipedia.org.
- Википедия (2017) Сульфат натрия. Получено с: wikipedia.org.
- Википедия (2017) Теноардита. Получено с: wikipedia.org.
- Википедия (2017). Получено с: .wikipedia.org.


