Структура сульфата алюминия (Al2 (SO4) 3), применение, виды, токсичность
сульфат алюминия неорганическая соль алюминия формулы Al2(SO4)3, это обычно выглядит как белое твердое вещество с блестящими кристаллами. Цвет соединения будет зависеть от его концентрации железа и любых других примесей. Существует два основных типа сульфата алюминия: A и B.
На нижнем изображении показаны белые кристаллы гидратированного сульфата алюминия. Можно отметить отсутствие коричневых окрасок, указывающих на ионы железа в кристаллической решетке..

Сульфат алюминия - это соль, которая очень хорошо растворяется в воде, и в природе редко можно найти ее в безводной форме. Обычно гидратируется в форме октадекагидрата сульфата алюминия [Al2(SO4)3.18H2O] или гексадекагидрат [Al2(SO4)3.16H2O].
Кроме того, он может образовывать двойные соли с калием и аммонием, соединения, известные как квасцы. Частично это может быть связано со сродством воды в гидратах удерживать другие ионы, кроме алюминия.
Сульфат алюминия может разлагаться под действием воды в гидроксиде алюминия и серной кислоте. Это свойство позволило использовать его в качестве подкислителя почв.
Это также токсичное соединение, особенно при контакте с его порошком. Тем не менее, он имеет бесконечное число применений и применений, которые идут от очистки воды с помощью метода коагуляции, происходящего через его использование в нескольких отраслях промышленности, до его использования в терапевтических целях..
индекс
- 1 структура
- 2 Для чего это (использует)
- 2.1 Коагуляция или флокуляция воды
- 2.2 Использование в качестве протравы чернил и при разработке бумаги
- 2.3 Промышленное использование
- 2.4 Лекарственное и терапевтическое использование
- 2.5 Другое использование
- 3 Производство сульфата алюминия
- 4 Типа
- 5 Токсичность
- 6 Ссылки
структура
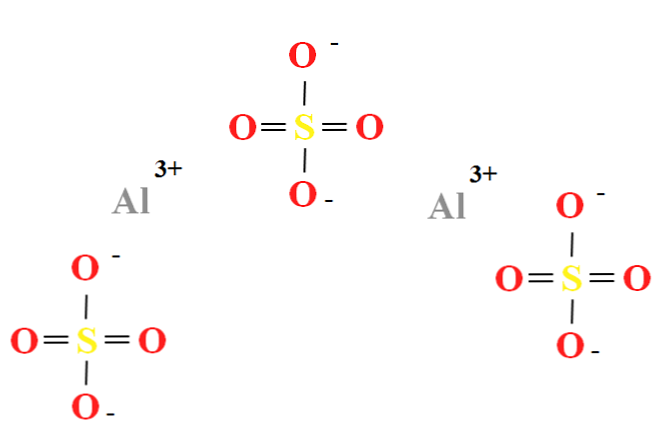
Сульфат алюминия имеет соотношение двух катионов Al3+ на каждые три аниона ТАК42- (верхнее изображение), что можно наблюдать непосредственно в его химической формуле Al2(SO4)3.
Обратите внимание, что Аль3+ они сероватые, а ТАК42- они желтые (для атома серы) и красные (для атомов кислорода).
Проиллюстрированная структура соответствует безводной форме Al2(SO4)3, так как ни одна молекула воды не взаимодействует с ионами. В ваших гидратах, однако, вода может быть привлечена к положительным центрам Al3+, или отрицательным SO тетраэдров42- через водородные связи (HOH-O-SO32-).
Аль2(SO4)3H 18H2Или, например, он содержит 18 молекул воды в своей твердой структуре. Некоторые из них могут находиться в прямом контакте с Алом3+ или с SO42-. Другими словами: сульфат алюминия может иметь внутреннюю или внешнюю координационную воду.
Кроме того, его структура может вместить другие катионы, такие как Fe3+, не доступно+, К+, и т.д. Но для этого необходимо присутствие большего количества анионов ТАК42-. Для чего? Для нейтрализации увеличения положительных зарядов за счет металлических примесей.
Сульфат алюминия может иметь много структур, хотя его гидраты имеют тенденцию принимать моноклинную кристаллическую систему.
Физико-химические свойства
внешний вид
Он выглядит как твердое вещество с блестящими белыми кристаллами, гранулами или порошком.
Молекулярный вес
342,31 г / моль (безводный).
запах
Без запаха
аромат
Сладкий вкус умеренно вяжущий.
Точка плавления
770ºС безводная форма (86,5ºС октадекагидратада)
Растворимость в воде
31,2 г / 100 мл при 0 ° С; 36,4 г / 100 мл при 20 ° С и 89 г / 100 мл при 100 ° С.
плотность
От 2,67 до 2,71 г / см3.
растворимость
Слабо растворим в этиловом спирте.
Давление пара
По сути ноль.
стабильность
Стабильный в воздухе.
разложение
При нагревании примерно до точки плавления он может разлагаться, выделяя, в частности, оксид серы, токсичный газ..
коррозионная активность
Растворы сульфата алюминия вызывают коррозию алюминия. Также соединение может разъедать металлы в присутствии влаги.
рКа
3,3 до 3,6. И его pH составляет 2,9 или более в 5% водном растворе.
Для чего это (использует)
Коагуляция или флокуляция воды
-При смешивании с водой (пригодной для питья, подачи или отходов) сульфат алюминия вызывает образование гидроксида алюминия, который образует комплексы с соединениями и частицами в растворе, ускоряя их осаждение, что в отсутствие обработки сульфатом алюминия может привести к долгое время.
-Сульфат алюминия также используется при очистке воды в бассейне, что делает его более привлекательным для использования.
-Благодаря использованию сульфата алюминия вода получается без мутности и цвета, что повышает ее способность к обработке за счет облегчения очистки воды. К сожалению, этот метод очистки может привести к незначительному увеличению концентрации алюминия в воде..
-Алюминий является очень токсичным металлом, который накапливается в коже, мозге и легких, вызывая серьезные нарушения. Кроме того, неизвестно, какую функцию он выполняет в живых существах..
-Европейский Союз требует, чтобы максимально допустимый предел содержания алюминия в воде не превышал 0,2 мг / л. Между тем, Агентство по охране окружающей среды США требует, чтобы максимальный предел загрязнения воды алюминием не превышал 0,05-0,2 мг / л..
-Очистка сточных вод или использование сульфата алюминия позволяет экономно удалять или уменьшать содержание фосфора в них..
Использование в качестве протравы чернил и при разработке бумаги
-Сульфат алюминия использовался в качестве протравы для красителей или чернил, помогая закрепиться на красящем материале. Его фиксирующее действие обусловлено Al (OH)3, чья желатиновая консистенция способствует адсорбции красителей на текстиле.
-Хотя он использовался примерно с 2000 г. до н.э. для описанной цели, только органические красители требуют морилки. Синтетические красители, с другой стороны, не требуют протравы для выполнения своей функции.
-Это было вытеснено из производства бумаги, но это все еще используется в производстве бумажной массы. Удаляет примеси, а также используется для связывания материалов, нейтрализации зарядов и калибровки канифоли.
Промышленное использование
-Он используется в строительной промышленности для ускорения схватывания бетона. Кроме того, он используется в гидроизоляции зданий.
-В производстве мыла и жиров он используется в производстве глицерина.
-Он используется в нефтяной промышленности при производстве синтетических катализаторов, которые используются во время эксплуатации.
-Он используется в фармацевтической промышленности в качестве вяжущего при приготовлении лекарств и косметики.
-Вмешивается в производство красителей, таких как кармин. Он также используется в качестве красителя при производстве синтетических каучуков бутадиен-стирола..
-В сахарной промышленности его используют в качестве очистителя мелассы для сахарного тростника..
-Используется при изготовлении дезодорантов. Почему? Потому что это вызывает сужение протоков потовых желез, ограничивая тем самым накопление пота, необходимой среды для роста бактерий, вызывающих запах.
-Используется при дублении кожи, необходим процесс его использования. Кроме того, он используется в производстве удобрений.
-Используется в качестве добавки при приготовлении красок, адгезивов и герметиков, а также в средствах для чистки и ухода за мебелью..
Лечебное и терапевтическое использование
-Сульфат алюминия является иммунологическим адъювантом. Следовательно, он выполняет функцию обработки антигенов таким образом, что при высвобождении в месте их действия они производят большую продукцию антител к антигенам, которые были инокулированы..
-Адъювант Фрейнда и БЦЖ, а также другие адъюванты, в том числе эндогенные, такие как интерлейкины, неспецифичны для антигенов, что позволяет увеличить радиус действия иммунитета. Это позволило разработать вакцины против многочисленных заболеваний.
-Коагулирующее действие сульфата алюминия позволило устранить многочисленные вирусы в очищенной воде, среди прочего: Q бета, MS2, T4 и P1. Результаты показывают, что обработка воды сульфатом алюминия приводит к инактивации таких вирусов..
-Сульфат алюминия используется в форме карандаша или в виде порошка при лечении мелких поверхностных ран или ссадин, возникающих при бритье.
-Он используется в производстве ацетата алюминия, соединения, используемого при лечении некоторых заболеваний уха. Он также использовался без особого успеха для смягчения последствий укусов муравьев..
-Растворы сульфата алюминия используются в концентрации от 5 до 10% при местном лечении язв, что позволяет контролировать их секрецию.
-Вяжущее действие сульфата алюминия сокращает поверхностные слои кожи, коагулируя белки и заживляя раны.
Другое использование
-Сульфат алюминия помогает контролировать чрезмерный рост водорослей в прудах, озерах и в потоках воды. Он также используется для удаления моллюсков, в том числе испанского слизняка.
-Садовники применяют это соединение для подкисления щелочных почв. При контакте с его водой сульфат алюминия разлагается на гидроксид алюминия и разбавленную серную кислоту. Затем гидроксид алюминия выпадает в осадок, оставляя серную кислоту в растворе.
-Подкисление почв из-за серной кислоты визуализируется очень творчески, благодаря наличию растения под названием гортензия, чьи цветы становятся синими в присутствии кислой почвы; то есть они чувствительны и реагируют на изменения pH.
-Сульфат алюминия участвует в производстве пены для борьбы с огнем и борьбы с ним. Как? Реагирует с бикарбонатом натрия с выделением СО2. Этот газ блокирует доступ O2 до места сгорания материала; и, следовательно, прекращение огня, которое развивалось.
Производство сульфата алюминия
Сульфат алюминия синтезируется путем взаимодействия обогащенного алюминием соединения, такого как бокситовая руда, с серной кислотой при повышенных температурах. Следующее химическое уравнение представляет реакцию:
в2О3 + H2SW4 -> Ал2(SO4)3 + 3 ч2О
Сульфат алюминия также может образовываться в результате реакции нейтрализации между гидроксидом алюминия и серной кислотой в соответствии со следующей реакцией:
2 Al (OH)3 + 3 ч2SW4 + 12 ч2O -> Al2(SO4)3.18H2О
Серная кислота вступает в реакцию с алюминием, образуя сульфат аммония и выделяя молекулы водорода в виде газа. Реакция схематизируется следующим образом:
2 Al + 3 H2SW4 -> Ал2(SO4)3 + 3 ч2
тип
Сульфат алюминия подразделяется на два типа: тип A и тип B. В сульфате алюминия типа A твердые вещества имеют белый цвет и имеют концентрацию железа менее 0,5%..
В сульфате алюминия типа B твердые вещества коричневые и имеют концентрацию железа менее 1,5%..
Есть отрасли, производящие сульфат алюминия, которые имеют различные критерии для их классификации. Так, промышленность сообщает, что для его приготовления сульфата алюминия типа А максимальная концентрация железа составляет 0,1% в виде оксида железа. В то время как для типа B они указывают максимальную концентрацию железа 0,35%.
токсичность
-Сульфат алюминия - это соединение, которое оказывает токсическое действие при контакте с пылью, вызывая раздражение кожи, а в случаях частого контакта - дерматит..
-В глазах это вызывает сильное раздражение, даже вызывает постоянные травмы..
-Вдыхание вызывает раздражение носа и горла, что может вызвать кашель и сыпь.
-Его прием вызывает раздражение желудка, тошноту и рвоту.
-Существуют токсические эффекты, которые, хотя они не связаны непосредственно с сульфатом алюминия, косвенно связаны с их использованием. Это случай определенных токсических эффектов алюминия, вызванных использованием сульфата алюминия при очистке воды..
-Пациенты, которые подвергаются хроническому диализу с использованием солей, приготовленных в очищенной воде, с использованием сульфата алюминия, испытывают очень серьезные нарушения здоровья. Среди этих нарушений у нас есть анемия, деменция при диализе и рост заболеваний костей..
ссылки
- Wikipedia. (2018). Сульфат алюминия Взято из: en.wikipedia.org
- Арис Индастриал Раствор сульфата алюминия типа А и В. Взято с сайта: aris.com.pe
- Кристофер Бойд (9 июня 2014 г.) Лучшие промышленные применения для сульфата алюминия. Взято из: chemservice.com
- PubChem. (2018). Сульфат алюминия безводный. Взято из: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20 августа 2009 г.) Лист безопасности из сульфата алюминия. [PDF]. Взято из: andesia.com
- Химическая Книга. (2017). Сульфат алюминия. Взято из: chemicalbook.com


