Физико-химические свойства, соли и примеры органических солей
органические соли они представляют собой плотное количество ионных соединений с бесчисленными характеристиками. Они получены ранее из органического соединения, которое подверглось трансформации, которая позволяет ему быть носителем заряда, а также, что его химическая идентичность зависит от связанного иона.
На рисунке ниже показаны две очень общие химические формулы для органических солей. Первый, R-AX, интерпретируется как соединение, в структуре углерода которого атом или группа А несет положительный заряд + или отрицательный (-).
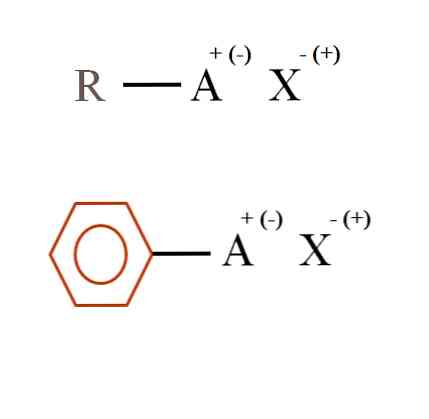
Как можно видеть, существует ковалентная связь между R и A, R-A, но, в свою очередь, A имеет формальный заряд, который притягивает (или отталкивает) ион X. Знак заряда будет зависеть от природы A и химической среды.
Если бы А был положительным, со скольким Х он мог бы взаимодействовать? Только с одним, учитывая принцип электронейтральности (+ 1-1 = 0). Тем не менее, какова идентичность X? Анион Х может быть СО32-, требующий двух катионов РА+; галогенид: F-, Cl-, бром-, и т.д .; или даже другое соединение РА-. Варианты неисчислимы.
Кроме того, органическая соль может иметь ароматический характер, проиллюстрированный коричневым бензольным кольцом. Бензоатная соль меди (II), (С6H5COO)2Например, Cu состоит из двух ароматических колец с отрицательно заряженными карбоксильными группами, которые взаимодействуют с катионом Cu.2+.
индекс
- 1 Физико-химические свойства
- 1.1 Высокие молекулярные массы
- 1.2 Амфифилы и поверхностно-активные вещества
- 1.3 Высокая температура кипения или плавления
- 1.4 Кислотность и основность
- 2 использования
- 3 Примеры органических солей
- 3.1 Карбоксилаты
- 3.2 Литиевые диакрилопраты
- 3.3 Соли сульфония
- 3.4 Соли оксония
- 3.5 Аминные соли
- 3.6 Диазониевые соли
- 4 Ссылки
Физико-химические свойства
Из изображения можно констатировать, что органические соли состоят из трех компонентов: органического, R или Ar (ароматическое кольцо), атома или группы, несущей ионный заряд A, и противоиона X.
Так же, как химическая идентичность и структура определяются такими компонентами, их свойства зависят от них..
Из этого факта можно резюмировать некоторые общие свойства, которым соответствует подавляющее большинство этих солей.
Высокие молекулярные массы
Предполагая моно- или поливалентные неорганические X-анионы, органические соли обычно имеют гораздо большую молекулярную массу, чем неорганические соли. Это происходит главным образом из-за углеродного скелета, чьи простые связи C-C и их атомы водорода вносят большой вклад в соединение..
Следовательно, они являются R или Ar, ответственными за их высокий молекулярный вес.
Амфифилы и поверхностно-активные вещества
Органические соли являются амфифильными соединениями, то есть их структуры имеют как гидрофильные, так и гидрофобные концы.
Каковы такие крайности? R или Ar представляют собой гидрофобный конец, потому что их атомы C и H не имеют большого сродства к молекулам воды..
+(-), атом или группа, несущая заряд, является гидрофильным концом, поскольку он вносит вклад в дипольный момент и взаимодействует с диполами, образующими воду (RA+ Огайо2).
Когда гидрофильные и гидрофобные области поляризованы, амфифильная соль становится поверхностно-активным веществом, веществом, широко используемым для изготовления моющих средств и деэмульгаторов.
Высокая температура кипения или плавления
Как и неорганические соли, органические соли также имеют высокие температуры плавления и кипения из-за электростатических сил, которые действуют в жидкой или твердой фазе..
Однако, имея органический компонент R или Ar, другие типы ван-дер-ваальсовых сил (силы Лондона, диполь-дипольные, водородные мостики), которые определенным образом конкурируют с электростатическим.
По этой причине твердые или жидкие структуры органических солей являются, в первую очередь, более сложными и разнообразными. Некоторые из них могут даже вести себя как жидкие кристаллы.
Кислотность и основность
Органические соли обычно являются более сильными кислотами или основаниями, чем неорганические соли. Это связано с тем, что А, например, в аминных солях, имеет положительный заряд благодаря своей связи с дополнительным водородом: А+-H. Затем, при контакте с основанием, пожертвуйте протон, чтобы он вернулся в нейтральное соединение:
RA+H + B => RA + HB
H принадлежит A, но он написан так, как он вмешивается в реакцию нейтрализации.
С другой стороны, РА+ это может быть большая молекула, неспособная образовывать твердые вещества с кристаллической сетью, достаточно стабильной с гидроксильным анионом или гидроксильным ОН-.
Когда это так, соль РА+Огайо- ведет себя как прочная база; даже такой простой, как NaOH или KOH:
RA+Огайо- + HCl => RACl + H2О
Обратите внимание в химическом уравнении, что анион Cl- это заменяет ОН-, образуя соль РА+Cl-.
приложений
Использование органических солей будет варьироваться в зависимости от идентичности R, Ar, A и X. Кроме того, применение, для которого они предназначены, также зависит от типа твердого вещества или жидкости, которые они образуют. Некоторые общие черты в этом отношении:
-Они служат реагентами для синтеза других органических соединений. RAX может выступать в роли «донора» R-цепи, добавляемой в другое соединение, заменяя хорошую исходящую группу.
-Они являются поверхностно-активными веществами, поэтому их также можно использовать в качестве смазок. Для этой цели используются соли металлов карбоксилатов..
-Они позволяют синтезировать широкий спектр красителей.
Примеры органических солей
карбоксилаты
Карбоновые кислоты реагируют с гидроксидом в реакции нейтрализации, давая соли карбоксилатов: RCOO- M+; где М+ Это может быть любой катион металла (Na+, Pb2+, К+, и т. д.) или аммониевый катион NH4+.
Жирные кислоты представляют собой длинноцепочечные алифатические карбоновые кислоты, они могут быть насыщенными и ненасыщенными. Пальмитиновая кислота (СН) входит в число насыщенных3(СН2)14СООН). Это дает пальмитат соль, а стеариновая кислота (CH3(СН2)16COOH образует стеаратную соль. Мыла состоят из этих солей.
В случае бензойной кислоты, С6H5COOH (где C6H5- это бензольное кольцо), когда оно реагирует с основанием, образует бензоатные соли. Во всех карбоксилатах группа -COO- представляет A (RAX).
Диакупрат лития
Диакупрат лития полезен в органическом синтезе. Его формула [R-Cu-R]-Li+, в котором атом меди несет отрицательный заряд. Здесь медь представляет собой атом А изображения.
Сульфониевые соли
Они образуются в результате реакции органического сульфида с алкилгалогенидом:
R2S + R'X => R2R'S+X
Для этих солей атом серы несет положительный формальный заряд (S+) имеющие три ковалентные связи.
Соли оксония
Кроме того, простые эфиры (оксигенированные аналоги сульфидов) реагируют с гидроцидами с образованием солей оксония:
ROR '+ HBr <=> RO+HR '+ Br-
Кислотный протон HBr ковалентно связан с атомом кислорода эфира (R2О+-H), загружая его положительно.
Соли амина
Амины могут быть первичными, вторичными, третичными или четвертичными, а также их соли. Все они характеризуются наличием атома Н, связанного с атомом азота.
Итак, РНХ3+X- это первичная соль амина; R2Нью-Гемпшир2+X-, вторичного амина; R3Нью-Гемпшир+X-, третичного амина; и R4N+X-, четвертичного амина (четвертичная аммониевая соль).
Соли диазония
Наконец, соли диазония (РН2+X-) или арилдиазоний (ArN)2+X-), представляют собой отправную точку для многих органических соединений, особенно азокрасителей.
ссылки
- Фрэнсис А. Кэри. Органическая химия (Шестое издание. С. 604-605, 697-698, 924). Mc Graw Hill.
- Грэм Соломонс Т.В., Крейг Б. Фрайл. Органическая химия. Амины. (10-е издание.). Wiley Plus.
- Wikipedia. (2018). Соль (химия). Взято из: en.wikipedia.org
- Стивен А. Хардингер. (2017). Иллюстрированный словарь по органической химии: соли. Получено от: chem.ucla.edu
- Шеврон Оронит. (2011). Карбоксилаты. [PDF]. Получено с: oronite.com


