Структура гидроксида аммония, свойства, номенклатура, применение
гидроксид аммония представляет собой соединение NH молекулярной формулы4ОН или Н5НЕ производится растворением газообразного аммиака (NH3в воде. По этой причине он получает названия аммиачной воды или жидкого аммиака.
Это бесцветная жидкость с очень интенсивным и острым запахом, которая не изолирует. Эти характеристики имеют прямую связь с концентрацией NH3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может покрывать его огромное количество, растворенное в небольшом объеме воды.
Значительно небольшая часть этих водных растворов состоит из катионов NH.4+ и ОН-анионы-. С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак можно найти в форме гидратов, таких как: NH3∙ H2О, 2НХ3∙ H2O и NH3H 2H2О.
Любопытно, что облака Юпитера образованы разбавленными растворами гидроксида аммония. Однако космическому зонду Galileo не удалось обнаружить воду в облаках планеты, что можно было бы ожидать из знания того, что известно образование гидроксида аммония; то есть они кристаллы NH4ОН абсолютно безводный.
Ион аммония (NH4+) вырабатывается в просвете почечных канальцев путем соединения аммиака и водорода, секретируемых клетками почечных канальцев. Аналогичным образом, аммоний вырабатывается в клетках почечных канальцев в процессе превращения глютамина в глутамат и, в свою очередь, при превращении глутамата в α-кетоглутарат..
Аммиак производится промышленным способом по методу Хабера-Боша, в котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакцию проводят при высоких давлениях (150-300 атмосфер) и высоких температурах (400-500 ºC) с выходом 10-20%..
В реакции образуется аммиак, который при окислении производит нитриты и нитраты. Они необходимы при получении азотной кислоты и удобрений, таких как аммиачная селитра.
индекс
- 1 Химическая структура
- 1.1 Аммиачный лед
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешний вид
- 2.4 Концентрация
- 2.5 Запах
- 2.6 Вкус
- 2.7 Пороговое значение
- 2.8 Точка кипения
- 2.9 Растворимость
- 2.10 Растворимость в воде
- 2.11 Плотность
- 2.12 Плотность пара
- 2.13 Давление пара
- 2.14 Коррозионное действие
- 2,15 рН
- 2.16 Константа диссоциации
- 3 Номенклатура
- 4 Растворимость
- 5 рисков
- 5.1 Реакционная способность
- 6 использует
- 6.1 В еду
- 6.2 Терапия
- 6.3 Промышленное и разное
- 6.4 В сельском хозяйстве
- 7 ссылок
Химическая структура
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4+ и ОН- сольватированные молекулами воды.
Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
Нью-Гемпшир3(г) + Н2O (l) <=> Нью-Гемпшир4+(ac) + OH-(Aq)
Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
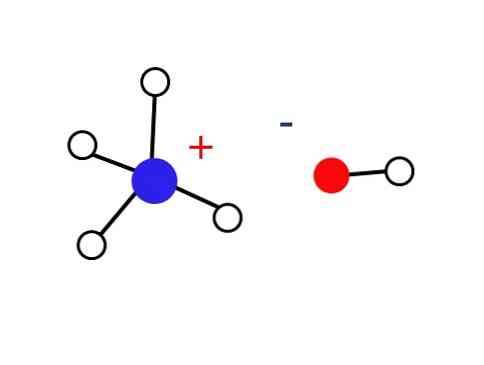
По этой причине ионы NH4+ и ОН- им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
Нью-Гемпшир3(s) + H2O (s) <=> Нью-Гемпшир4ОН
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака.
Физико-химические свойства
Молекулярная формула
Нью-Гемпшир4ОН или Н5НЕТ
Молекулярный вес
35 046 г / моль
внешний вид
Это бесцветная жидкость.
концентрация
Примерно до 30% (для ионов NH4+ и ОН-).
запах
Очень сильный и острый.
аромат
акр.
Пороговое значение
34 промилле для неспецифического обнаружения.
Точка кипения
38 ºC (25%).
растворимость
Существует только в водном растворе.
Растворимость в воде
Смешивается в неограниченных пропорциях.
плотность
0,90 г / см3 при 25 ºC.
Плотность пара
Относительно воздуха, взятого за единицу измерения: 0,6. То есть он менее плотный, чем воздух. Однако, по логике, указанное значение относится к аммиаку как газу, а не к его водным растворам или NH4Огайо.
Давление пара
2,160 мм рт.ст. при 25 ºC.
Коррозионное действие
Способен растворять цинк и медь.
pH
11,6 (раствор 1 N); 11,1 (раствор 0,1 N) и 10,6 (0,01 н. раствор).
Константа диссоциации
pKb = 4767; Кб = 1,71 х 10-5 при 20 ºC
pKb = 4,751; Кб = 1774 х 10-5 при 25 º C.
Повышение температуры почти незаметно увеличивает основность гидроксида аммония.
номенклатура
Каковы все общие и официальные имена, которые получает NH?4ОН? Согласно тому, что установлено IUPAC, его название - гидроксид аммония, потому что он содержит гидроксильный анион..
Аммоний по нагрузке +1 является одновалентным, поэтому при использовании номенклатурного запаса он называется: гидроксид аммония (I).
Хотя использование термина гидроксид аммония технически некорректно, поскольку соединение не может быть выделено (по крайней мере, не на Земле, как подробно объясняется в первом разделе).
Кроме того, гидроксид аммония получает названия аммиачной воды и жидкого аммиака.
растворимость
NH4ОН, поскольку в земных условиях соли нет, невозможно оценить, насколько она растворима в разных растворителях..
Однако можно было бы ожидать, что он будет чрезвычайно растворим в воде, так как при его растворении выделяется огромное количество NH.3. Теоретически, это был бы удивительный способ хранения и транспортировки аммиака..
Можно ожидать, что в других растворителях, способных принимать водородные связи, таких как спирты и амины, он также будет очень растворим в них. Здесь катион NH4+ является донором водородных мостиков, а ОН- это работает как.
Примерами этих взаимодействий с метанолом могут быть: H3N+-H - OHCH3 и HO- - HOCH3 (OHCH3 указывает на то, что кислород получает водородную связь, а не на то, что метильная группа связана с Н).
риски
-При попадании в глаза вызывает раздражение, которое может привести к повреждению глаз.
-Это вызывает коррозию. Поэтому при попадании на кожу может вызывать раздражение, а при высоких концентрациях реагента вызывает ожоги кожи. Повторный контакт гидроксида аммония с кожей может вызвать ее сухость, зуд и покраснение (дерматит).
-Вдыхание аэрозоля с гидроксидом аммония может вызвать острое раздражение дыхательных путей, которое характеризуется удушьем, кашлем или одышкой. Длительное или повторное воздействие вещества может привести к рецидивирующим бронхиальным инфекциям. Кроме того, вдыхание гидроксида аммония может вызвать раздражение легких.
-Воздействие высоких концентраций гидроксида аммония может быть неотложной медицинской помощью, так как может произойти накопление жидкости в легких (отек легких).
-Концентрация 25 частей на миллион была принята за предел воздействия в течение 8-часовой рабочей смены в среде, где работник подвергается вредному действию гидроксида аммония..
реактивность
-Кроме того, из потенциального вреда для здоровья от воздействия гидроксида аммония, есть другие меры предосторожности, которые необходимо учитывать при работе с веществом.
-Гидроксид аммония может вступать в реакцию со многими металлами, такими как: серебро, медь, свинец и цинк. Он также реагирует с солями этих металлов с образованием взрывоопасных соединений и выделяет газообразный водород; который, в свою очередь, является легковоспламеняющимся и взрывоопасным.
-Он может бурно реагировать с сильными кислотами, например: соляной кислотой, серной кислотой и азотной кислотой. Кроме того, он реагирует таким же образом с диметилсульфатом и галогенами.
-Реагирует с сильными основаниями, такими как гидроксид натрия и гидроксид калия, с образованием газообразного аммиака. Это можно проверить, если наблюдается равновесие в растворе, при котором добавление ионов ОН- сдвигает баланс к образованию NH3.
-Медные и алюминиевые металлы, а также другие оцинкованные металлы не должны использоваться при работе с гидроксидом аммония из-за его коррозионного воздействия на них..
приложений
В еду
-Он используется в качестве добавки во многих пищевых продуктах, в которых он действует как разрыхлитель, регулятор pH и отделочный агент поверхности пищи..
-Список продуктов, в которых используется гидроксид аммония, обширен и включает выпечку, сыры, шоколад, конфеты и пудинги.
-Гидроокись аммония классифицируется FDA как безопасное вещество для обработки пищевых продуктов при условии соблюдения установленных стандартов..
-В мясных продуктах он используется в качестве антимикробного агента, способного уничтожать бактерии, такие как кишечная палочка, и снижать его до неопределяемого уровня. Бактерия обнаружена в кишечнике крупного рогатого скота, адаптируясь к кислой среде. Гидроксид аммония, регулируя рН, препятствует росту бактерий.
терапевтический
-Гидроксид аммония имеет несколько терапевтических применений, в том числе:
-10% раствор используется как стимулятор дыхательного рефлекса
-Внешне он используется на коже для лечения укусов и укусов насекомых. Он действует на пищеварительную систему как антацидное и ветрогонное средство, то есть помогает устранять газы..
Кроме того, он используется в качестве местного средства для лечения острых и хронических мышечно-скелетных болей. Как следствие рубцового действия гидроксида аммония наблюдается местное усиление кровотока, покраснение и раздражение.
Промышленное и разное
-Он действует в сокращении NOx (высокореактивных газов, таких как оксид азота (NO) и диоксид азота (NO)2)) для дымовых выбросов и сокращения выбросов NOx в дымовых трубах.
-Используется в качестве пластифицирующего агента; Добавка красок и для обработки поверхностей.
-Это увеличивает пористость волос, позволяя пигментам пятен иметь большее проникновение, что обеспечивает лучший результат.
-Гидроксид аммония используется в качестве антимикробного агента при очистке сточных вод. Кроме того, он вмешивается в синтез хлорамина. Это вещество выполняет функцию, аналогичную хлору, при очистке воды в плавательном бассейне, имея преимущество в том, что она менее токсична..
-Используется в качестве ингибитора коррозии в процессе переработки нефти..
-Он используется в качестве чистящего средства в различных промышленных и коммерческих продуктах, используемых на нескольких поверхностях, в том числе: нержавеющая сталь, фарфор, стекло и духовка..
-Кроме того, он используется в производстве моющих средств, мыла, фармацевтических препаратов и чернил.
В сельском хозяйстве
Гидроксид аммония, хотя и не применяется непосредственно в качестве удобрения, выполняет эту функцию. Аммиак производится из атмосферного азота по методу Хабера-Боша и транспортируется в холодильнике ниже точки кипения (-33 ° С) к местам его использования.
Аммиак под давлением впрыскивается в виде пара в почву, где он немедленно вступает в реакцию с эдафической водой и переходит в форму аммония (NH4+), который сохраняется в местах катионного обмена почвы. Кроме того, производится гидроксид аммония. Эти соединения являются источником азота.
Вместе с фосфором и калием азот составляет триаду основных питательных веществ растений, необходимых для его роста..
ссылки
- Ganong, W.F. (2002). Медицинская физиология. 19-е издание. Редакция Современное руководство.
- A. D. Fortes, J. P. Brodholt, I. G. Wood и L. Vocadlo. (2001). Первоначальное моделирование моногидрата аммиака (NH3∙ H2О) и гидроксид аммония (NH4ОН). Американский институт физики. J. Chem. Phys., Vol. 115, No. 15, 15.
- Хельменстин, Анна Мари, доктор философии (6 февраля 2017 г.) Факты о гидроксиде аммония. Получено с: мысли
- Группа Почтека. (2015). Гидроксид аммония. pochteca.com.mx
- Нью-Джерси Здоровье (Н.Д.). Информационный бюллетень по опасным веществам: гидроксид аммония. [PDF]. Получено от: nj.gov
- Учитель химии. (2018). Гидроксид аммония. Получено от: chemlearner.com
- PubChem. (2018). Гидроксид аммония. Получено из: pubchem.ncbi.nlm.nih.gov


