Типы и примеры молекулярной геометрии
молекулярная геометрия или молекулярная структура пространственное распределение атомов вокруг центрального атома. Атомы представляют области, где существует высокая электронная плотность, и поэтому считаются электронными группами, независимо от того, какие связи образуют (одинарные, двойные или тройные)..
Эта концепция основана на комбинации и экспериментальных данных двух теорий: теории валентной связи (TEV) и отталкивания электронных пар валентной оболочки (VSPR). В то время как первый определяет связи и их углы, второй устанавливает геометрию и, следовательно, молекулярную структуру.

Какие геометрические формы могут принимать молекулы? Две предыдущие теории дают ответы. Согласно ВСЭПР, атомы и пары свободных электронов должны располагаться в пространстве таким образом, чтобы минимизировать электростатическое отталкивание между ними..
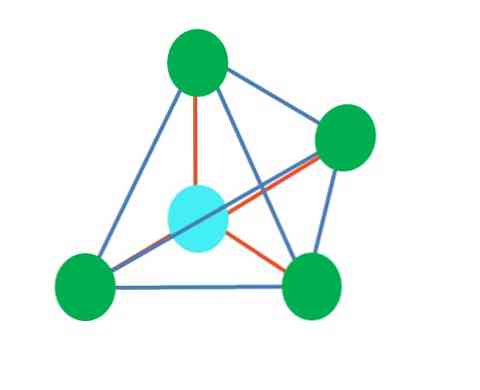
Таким образом, геометрические фигуры не являются произвольными, но искать наиболее устойчивый дизайн. Например, на верхнем изображении слева виден треугольник, а справа - октаэдр. Зеленые точки представляют атомы, а оранжевые полосы - ссылки..
В треугольнике три зеленые точки ориентированы на расстоянии 120º. Этот угол, равный углу связи, позволяет атомам отталкивать друг друга как можно меньше. Следовательно, молекула с центральным атомом, присоединенным к трем другим, примет геометрию тригональной плоскости..
Тем не менее, VSCR предсказывает, что свободная пара электронов в центральном атоме будет искажать геометрию. Для случая тригональной плоскости эта пара будет отталкивать три зеленые точки, что приведет к геометрии тригональной пирамиды..
То же самое может случиться и с октаэдром изображения. В нем все атомы разделены максимально устойчиво.
индекс
- 1 Как заранее узнать молекулярную геометрию атома X?
- 2 типа
- 2.1 Линейный
- 2.2 угловой
- 2.3 Тетраэдрический
- 2.4 Тригональная бипирамида
- 2,5 октаэдра
- 2.6 Другие молекулярные геометрии
- 3 примера
- 3.1 Линейная геометрия
- 3.2 Угловая геометрия
- 3.3 Треугольный план
- 3.4 Тетраэдрический
- 3.5 Треугольная пирамида
- 3.6 тригональная бипирамида
- 3.7 Колеблющийся
- 3.8 Форма Т
- 3.9 Октаэдра
- 4 Ссылки
Как заранее узнать молекулярную геометрию атома X?
Для этого необходимо также рассматривать пары свободных электронов как электронные группы. Они вместе с атомами будут определять то, что известно как электронная геометрия, который является неразлучным спутником молекулярной геометрии.
Из электронной геометрии и по обнаружению структурой Льюиса пар свободных электронов мы можем установить, какой будет молекулярная геометрия. Сумма всех молекулярных геометрий даст представление о глобальной структуре.
тип
Как видно из основного изображения, молекулярная геометрия зависит от того, сколько атомов окружает центральный атом. Однако, если пара электронов присутствует без разделения, она изменит геометрию, потому что она занимает много объема. Следовательно, он оказывает стерическое действие.
В соответствии с этим геометрия может представлять серию характерных форм для многих молекул. И именно здесь возникают различные типы молекулярной геометрии или молекулярной структуры.
Когда геометрия равна структуре? Оба обозначают одно и то же только в тех случаях, когда структура не имеет более одного типа геометрии; в противном случае необходимо учитывать все существующие типы, а структура должна иметь глобальное имя (линейное, разветвленное, глобулярное, плоское и т. д.)..
Геометрия особенно полезна для объяснения структуры твердого тела из его структурных единиц.
линейный
Все ковалентные связи являются направленными, поэтому связь A-B является линейной. Но будет ли молекула AB линейной?2? Если да, геометрия просто представлена как: B-A-B. Два атома B разделены углом 180 °, и согласно TEV, A должен иметь sp-гибридные орбитали.
угловая
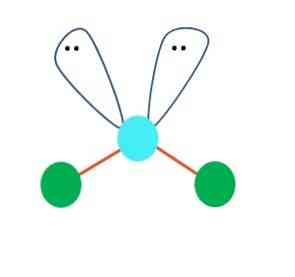
Можно предположить в первую очередь линейную геометрию для молекулы AB2; Тем не менее, важно нарисовать структуру Льюиса, прежде чем прийти к выводу. Рисуя структуру Льюиса, можно определить количество пар электронов без разделения (:) на атоме А.
Когда это так, поверх электронных пар они толкают два атома B вниз, изменяя их углы. В результате линейная молекула B-A-B в конечном итоге становится V, бумерангом или угловой геометрией (верхнее изображение)
Молекула воды, H-O-H, является идеальным примером для этого типа геометрии. В атоме кислорода есть две пары электронов без разделения, которые ориентированы под приблизительным углом 109º.
Почему этот угол? Потому что электронная геометрия является тетраэдрической, которая имеет четыре вершины: две для атомов H и две для электронов. На изображении выше обратите внимание, что зеленые точки и две «доли с глазами» рисуют тетраэдр с голубоватой точкой в центре.
Если бы у О не было пар свободных электронов, вода образовала бы линейную молекулу, ее полярность уменьшилась бы, и океаны, моря, озера и т. Д., Вероятно, не существовали бы, как они известны.
четырехгранный
Верхнее изображение представляет тетраэдрическую геометрию. Для молекулы воды ее электронная геометрия является тетраэдрической, но, удаляя пары без электронов, можно заметить, что она превращается в угловую геометрию. Это также наблюдается просто путем устранения двух зеленых точек; остальные два нарисуют V с синей точкой.
Что, если вместо двух пар свободных электронов был только один? Тогда была бы тригональная плоскость (основное изображение). Однако, исключая электронную группу, стерический эффект, создаваемый парой свободных электронов, не исключается. Следовательно, он искажает треугольную плоскость в треугольную базовую пирамиду:

Хотя геометрическая геометрия тригональной и тетраэдрической пирамиды различна, электронная геометрия одинакова: тетраэдрическая. Таким образом, треугольная пирамида не считается электронной геометрией?
Ответ - нет, поскольку это продукт искажения, вызванного «лепестком с глазами», и его стерического эффекта, и эта геометрия не учитывает последующие искажения..
По этой причине всегда важно сначала определить электронную геометрию с помощью структур Льюиса, прежде чем определять молекулярную геометрию. Молекула аммиака, NH3, пример молекулярной геометрии тригональной пирамиды, но с тетраэдрической электронной геометрией.
Тригональная бипирамида
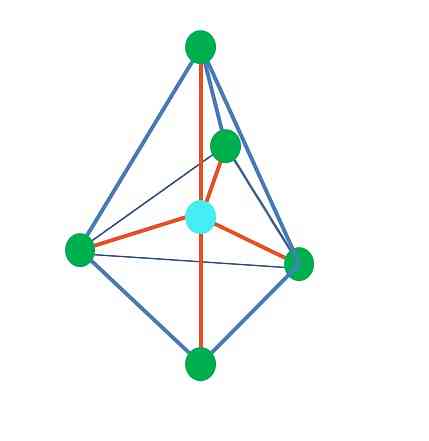
До сих пор, за исключением линейной геометрии, в тетраэдрической, угловой и тригональной пирамидах ее центральные атомы имеют sp-гибридизацию3, в соответствии с TEV. Это означает, что если углы вашей ссылки были определены экспериментально, они должны быть около 109º.
Из тригональной дипирамидальной геометрии вокруг центрального атома пять электронных групп. На верхнем изображении вы видите пять зеленых точек; три в треугольном основании и два в осевых положениях, которые являются верхней и нижней вершинами пирамиды.
Какую гибридизацию имеет голубая точка? Для образования простых связей (оранжевого цвета) нужны пять гибридных орбиталей. Это достигается с помощью пяти sp орбиталей3d (произведение смеси орбиталей s, три p и a d).
При рассмотрении пяти электронных групп геометрия - это та, которая уже выставлена, но имеет пары электронов без разделения, эта опять-таки страдает от искажений, которые генерируют другие геометрии. Также возникает следующий вопрос: могут ли эти пары занимать какую-либо позицию в пирамиде? Это: аксиальный или экваториальный.
Аксиальные и экваториальные позиции
Зеленые точки, составляющие треугольное основание, находятся в экваториальных положениях, а две на верхнем и нижнем концах - в осевых положениях. Где, предпочтительно, будет расположена пара электронов без деления? В таком положении, которое сводит к минимуму электростатическое отталкивание и стерический эффект.
В аксиальном положении пара электронов будет «давить» перпендикулярно (90º) на треугольном основании, в то время как если бы оно находилось в экваториальном положении, две оставшиеся электронные группы основания были бы на расстоянии 120º друг от друга и сжимали бы оба конца на 90º (вместо три, как с базой).
Поэтому центральный атом будет стремиться ориентировать свои безэлектронные пары в экваториальных положениях, чтобы генерировать более стабильные молекулярные геометрии.
Колеблющаяся и Т-образная форма
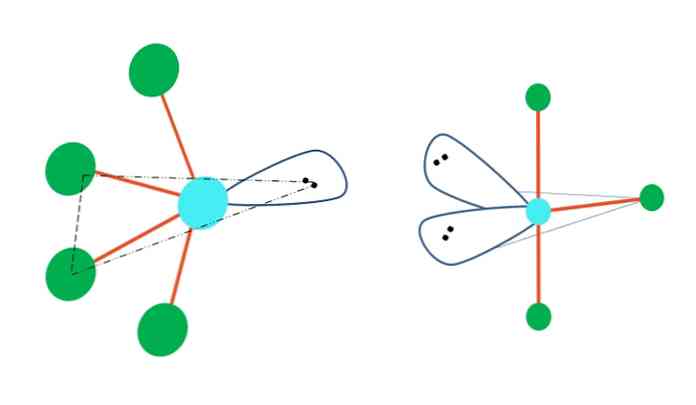
Если бы тригональная геометрия бипирамиды заменила один или несколько ее атомов безэлектронными парами, она также имела бы другую молекулярную геометрию.
Слева от верхнего изображения геометрия меняется на колеблющуюся форму. В ней свободная пара электронов толкает остальные четыре атома в одном направлении, складывая их связи влево. Обратите внимание, что эта пара и два атома лежат в одной треугольной плоскости исходной дипирамиды.
А справа от изображения - геометрия Т-образной формы. Эта молекулярная геометрия является результатом замены двух атомов двумя парами электронов, в результате чего оставшиеся три атома выровнены в одной плоскости, которая рисует ровно одну букву. T.
Итак, для молекулы типа AB5, он принимает треугольную геометрию бипирамиды. Тем не менее, AB4, с той же электронной геометрией, она примет колеблющуюся геометрию; и AB3, Т-образная геометрия. Во всех них А будет иметь (в основном) sp-гибридизацию3d.
Для определения геометрии молекулы необходимо нарисовать структуру Льюиса и, следовательно, ее электронную геометрию. Если это тригональная бипирамида, то свободные от электронов пары будут отбрасываться, но не их стерическое воздействие на остальные атомы. Таким образом, можно идеально различить три возможных молекулярных геометрии.
восьмигранный
Октаэдрическая молекулярная геометрия представлена справа от основного изображения. Этот тип геометрии соответствует соединениям AB6. AB4 они образуют квадратное основание, в то время как остальные два B расположены в осевом положении. Таким образом, образуются несколько равносторонних треугольников, которые являются гранями октаэдра.
Здесь, опять же, могут быть (как и во всех электронных геометриях) пары свободных электронов, и, следовательно, другие молекулярные геометрии происходят из этого факта. Например, АБ5 с восьмигранной электронной геометрией состоит из пирамиды с квадратным основанием и AB4 квадратной плоскости:
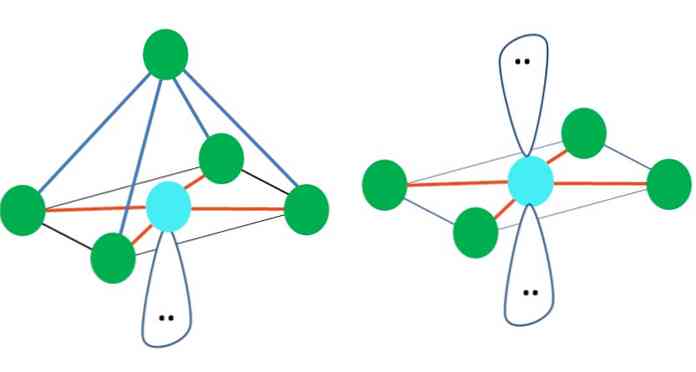
В случае октаэдрической электронной геометрии эти две молекулярные геометрии являются наиболее устойчивыми с точки зрения электростатического отталкивания. В квадратно-плоской геометрии две электронные пары расположены на расстоянии 180 °.
Какова гибридизация для атома А в этих геометриях (или структурах, если он единственный)? Опять же, TEV устанавливает, что это sp3d2, шесть гибридных орбиталей, что позволяет A ориентировать электронные группы по вершинам октаэдра.
Другие молекулярные геометрии
Модифицируя основания упомянутых выше пирамид, можно получить некоторые более сложные молекулярные геометрии. Например, пятиугольная бипирамида основана на пятиугольнике, и соединения, которые ее образуют, имеют общую формулу AB7.
Как и другие молекулярные геометрии, замена атомов B на пары без электронов приведет к искажению геометрии к другим формам..
Кроме того, соединения AB8 они могут принимать такие геометрии, как квадратная антипризма. Некоторые геометрии могут быть очень сложными, особенно для формул AB7 вперед (до AB12).
примеров
Далее будет упомянут ряд соединений для каждой из основных молекулярных геометрий. В качестве упражнения вы могли бы нарисовать структуры Льюиса для всех примеров и подтвердить, что, учитывая электронную геометрию, вы получаете молекулярную геометрию, как указано ниже..
Линейная геометрия
-Этилен, ч2C≡CH2
-Хлорид бериллия, BeCl2 (Cl-Be-Cl)
-Углекислый газ, СО2 (O = C = O)
-Азот, Н2 (N≡N)
-Дибромид ртути, HgBr2 (Br-Hg-Br)
-Анион трийодид, я3- (I-I-I),
-Цианид водорода, HCN (H-N≡C)
Его углы должны быть 180º, и, следовательно, иметь sp-гибридизацию.
Угловая геометрия
-Вода
-Диоксид серы, СО2
-Диоксид азота, НЕТ2
-Озон, О3
-Анион амидуро, NH2-
Тригональная плоскость
-Трифторид брома, BF3
-Алюминий трихлорид, AlCl3
-Нитрат-анион, НЕТ3-
-Анион карбонат, СО32-
четырехгранный
-Метан газ, СН4
-Четыреххлористый углерод, CCl4
-Катион аммония, NH4+
-Анион сульфат, СО42-
Треугольная пирамида
-Аммиак, NH3
-Катион гидроний, ч3О+
Тригональная бипирамида
-Пентафторид фосфора, ПФ5
-Пентахлорид сурьмы, SbF5
колеблющийся
Тетрафторид серы, SF4
Форма Т
-Трихлорид йода, ICl3
-Хлористый трифторид, ClF3 (оба соединения известны как интергалогены)
восьмигранный
-Сера гексафторид, SF6
-Селен гексафторид, SeF6
-Гексафторфосфат, ПФ6-
Кульминацией молекулярной геометрии является то, что объясняет наблюдения химических или физических свойств вещества. Тем не менее, он ориентирован в соответствии с электронной геометрией, так что последний всегда должен быть определен до первого.
ссылки
- Уиттен, Дэвис, Пек и Стэнли. Химия. (8-е изд.). CENGAGE Learning, стр. 194-198.
- Дрожь и Аткинс. (2008). Неорганическая химия (Четвертое издание. С. 23, 24, 80, 169). Mc Graw Hill.
- Марк Э. Такерман. (2011). Молекулярная геометрия и теория ВСЭПР. Получено от: nyu.edu
- Виртуальный Chembook, Чарльз Э. Офардт. (2003). Введение в молекулярную геометрию. Получено из: chem.elmhurst.edu
- Химия LibreTexts. (8 сентября 2016 г.) Геометрия молекул. Получено от: chem.libretexts.org


