Дихромат натрия свойства, производство, опасности и применение
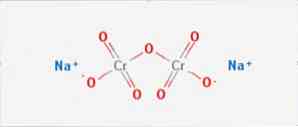
дихромат натрия неорганическое соединение формулы Na2Cr2O7. Это одно из многих соединений шестивалентного хрома (Cr VI). Его структура проиллюстрирована на рисунке 1, хотя обычно соль обрабатывается в дигидратированной форме, формула которой будет Na2Cr2O7 · H2O.
Он имеет две ионные связи между молекулами натрия и отрицательно заряженными атомами кислорода. Хромированная руда извлекается из дихромата натрия. Миллионы килограммов бихромата натрия производятся ежегодно.
Китай является крупнейшим производителем дихромата натрия, однако китайские химические заводы имеют относительно низкое производство, менее 50 000 тонн в год, по сравнению с казахстанским заводом, который производит более 100 000 тонн в год..
Заводы в России, Соединенных Штатах и Великобритании имеют промежуточное производство от 50 000 до 100 000 тонн в год (Kogel, 2006)..
С точки зрения реакционной способности и внешнего вида дихромат натрия обладает свойствами, аналогичными дихромату калия, однако натриевая соль более растворима в воде и имеет весовой эквивалент, меньший, чем у калиевой соли..
При нагревании дихромат натрия образует токсичные пары хрома. Это сильный окислитель и очень агрессивный.
Это соединение можно найти в источниках питьевой воды, загрязненных различными промышленными процессами, такими как гальванизация или гальваника, кожевенное дубление и текстильное производство..
индекс
- 1 Физико-химические свойства
- 2 Методы производства
- 3 Реактивность и опасности
- 4 Использование и применение
- 5 Биохимия
- 6 Ссылки
Физико-химические свойства
Дихромат натрия состоит из кристаллов с красно-оранжевой моноклинной структурой в их безводной форме и без запаха. Его молекулярная масса составляет 261,97 г / моль в безводной форме и 298,00 г / моль в его дигидратированной форме..
Он имеет температуру плавления 356,7 градусов по Цельсию, температуру кипения 400 градусов по Цельсию, при которой он разлагается. Он имеет плотность 2,52 г / мл..

Рисунок 2 показывает появление дихромата натрия. Его растворимость в воде составляет 187 г на 100 г при 25 градусах Цельсия, а его растворимость в этаноле составляет 513,2 г / литр при 19,4 градусах Цельсия (Национальный центр биотехнологической информации, s.f.).
Он считается стабильным соединением, если хранится в рекомендуемых условиях, и не воспламеняется. Поскольку это сильный окислитель, он вызывает коррозию, а в растворе это кислота, обладающая способностью снижать рН до 4 в растворе 1% мас. / Об..
Методы производства
Хромат натрия может быть преобразован в дихромат с помощью непрерывного процесса, который обрабатывает серной кислотой, диоксидом углерода или комбинацией этих двух.
Испарение раствора бихромата натрия вызывает осаждение сульфата натрия и / или бикарбоната натрия, и эти соединения удаляются перед окончательной кристаллизацией дихромата натрия..
Дихромат натрия можно сделать в три этапа:
- Щелочная обжарка в условиях окисления хромита
- Выщелачивание. Извлечение растворимых веществ из смеси под действием жидкого растворителя
- Превращение монохромата натрия в дихромат натрия с помощью кислоты.
Безводный дихромат натрия можно приготовить путем плавления дигидрата дигидрата натрия, кристаллизации водных растворов дихромата при температуре выше 86 ° C или сушки растворов дихромата натрия в распылительных сушилках..
Растворы дихромата натрия в количестве 69 и 70% мас. / Об. Используются в качестве удобного и экономически эффективного способа отправки количеств, избегая необходимости ручной обработки или растворения кристаллов..
Реактивность и опасности
Это сильный окислитель. Несовместимо с сильными кислотами. Контакт с горючими материалами может привести к пожару. Токсичные пары оксида хрома могут образовываться в присутствии тепла или огня.
Известная «смесь хромовой кислоты» дихромата и серной кислоты с органическими остатками вызывает бурную экзотермическую реакцию. Эта смесь в сочетании с остатками ацетона также приводит к бурной реакции.
Сочетание дихромата и серной кислоты со спиртами, этанолом и 2-пропанолом приводит к бурной экзотермической реакции. В связи со многими инцидентами, связанными со смешением дихромат-серной кислоты с окисляемыми органическими материалами, вероятно, лучше избегать таких взаимодействий..
Комбинация дихромата с гидразином является взрывоопасной, можно ожидать, что реакция с дихроматом в целом будет энергичной с аминами. Добавление обезвоженной дихроматной соли к уксусному ангидриду приводит к окончательной взрывной экзотермической реакции.
Бор, кремний и дихроматы образуют пиротехнические смеси. Смесь уксусной кислоты, 2-метил-2-пентеналя и дихромата приводит к безудержной реакции (Химический паспорт натрия бихромат., 2016).
Вдыхание пыли или тумана вызывает раздражение дыхательных путей, которое иногда напоминает астму. Может возникнуть перфорация перегородки. Считается ядом.
Проглатывание вызывает рвоту, диарею и, что очень необычно, осложнения со стороны желудка и почек. Контакт с глазами или кожей вызывает местное раздражение. Повторное воздействие на кожу вызывает дерматит.
Дихромат натрия является канцерогеном для человека. Существуют доказательства того, что соединения шестивалентного хрома или Cr (VI) могут вызывать рак легких у людей. Было показано, что дихромат натрия вызывает рак легких у животных.
Хотя дихромат натрия не был идентифицирован как тератогенное соединение или репродуктивный риск, известно, что соединения шестивалентного хрома или Cr (VI) являются тератогенными и вызывают репродуктивное повреждение, такое как снижение фертильности и нарушение менструальных циклов..
Дихромат натрия может вызвать повреждение печени и почек, поэтому с ним следует обращаться с особой осторожностью (Департамент здравоохранения Нью-Джерси, 2009 г.).
В случае проглатывания жертва должна пить воду или молоко; никогда не вызывать рвоту. При попадании на кожу или в глаза его следует рассматривать как кислотные ожоги; Промойте глаза водой не менее 15 минут.
Внешние поражения можно натирать 2% -ным раствором тиосульфата натрия. Во всех случаях следует проконсультироваться с врачом.
Использование и приложения
Помимо важности в производстве других химических соединений хрома, дихромат натрия также имеет множество прямых применений в качестве ингредиента при производстве:
- Металлическая отделка: способствует коррозионной стойкости и очищает металлические поверхности, а также способствует адгезии краски.
- Органические продукты: используются в качестве окислителей при производстве таких продуктов, как витамин К и воск.
- Пигменты: используются при изготовлении неорганических хроматовых пигментов, где он дает диапазон цветов, устойчивых к свету. Некоторые сорта хромата также используются в качестве ингибиторов коррозии в нижних слоях и грунтовках..
- Керамика: используется при изготовлении цветных стекол и керамических глазурей.
- Текстиль: используется в качестве протравы для кислотных красителей, чтобы улучшить свои быстродействующие свойства.
- Производство сульфата хрома.
(Дихромат натрия, строительный блок для практически всех других соединений хрома., 2010-2012)
Дихромат натрия дигидрат, его использование идеально в различных условиях, в том числе при высоких температурах, таких как керамические глазури и цветное стекло.
Оксид хрома, твердее других оксидов металлов, таких как титан или железо, идеально подходит для сред, где температура и условия процесса агрессивны.
Это вещество в основном используется для производства других соединений хрома, но оно также используется в бентонитовых грязях, используемых при производстве нефти, в консервантах для древесины, в производстве органических химикатов и в качестве ингибитора коррозии..
При смешивании с алюминием и дихроматом калия с использованием алюмотермического процесса оксид хрома образует металлический хром высокой чистоты. Это жизненно важный ингредиент в производстве высокоэффективных суперсплавов, используемых в аэрокосмической промышленности..
В органическом синтезе дихромат натрия используется в качестве окислителя в окислительных реакциях восстановления в присутствии серной кислоты.
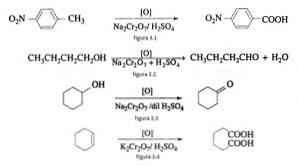
Например, окисление п-нитротолуола с образованием п-нитробензойной кислоты, окисление н-бутанола с образованием н-бутальдегида, образование циклогексанона из циклогексанола и образование адипиновой кислоты, как показано на рисунках 3.1. , 3,2, 3,3 и 3,4 соответственно (В. К. Ахлувалия, 2004).
биохимия
Интратрахеальная инстилляция дихромата натрия (CrVI) и гидроксида ацетата хрома (CrIII) у самцов крыс приводила к повышению концентрации хрома в цельной крови, плазме и моче вплоть до 72 часов после воздействия; Максимальные концентрации были достигнуты через 6 часов после воздействия.
Соотношение между концентрациями хрома в плазме крови и хрома в плазме значительно различалось при лечении Cr (VI) и Cr (III). Поэтому анализ хрома в крови и хрома в плазме следует использовать для оценки воздействия хрома.
Хром был также обнаружен в периферических лимфоцитах. Cr (VI), но не Cr (III), значительно накапливался в лимфоцитах после лечения. Эти клетки потенциально могут быть использованы в качестве биомаркеров при оценке воздействия соединений хрома (Hooth, 2008).
ссылки
- Химическая таблица данных Дихромат натрия. (2016). Получено из химических веществ камеи: cameochemicals.noaa.
- Hooth, M.J. (2008). Технический отчет по токсикологии и исследованиям канцерогенеза дигидрата дихромата натрия. Национальный институт здоровья США.
- Kogel, J.E. (2006). Промышленные минералы и горные породы: товары, рынки и использование седьмое издание. Littleton Colorado: общество горного дела, металлургии и геологоразведки.
- Национальный центр биотехнологической информации. (Н.Д.). База данных PubChem Compound; CID = 25408. Получено с pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Департамент здравоохранения Нью-Джерси. (2009 г., ноябрь). фактические данные по опасным веществам дихромат натрия. Получено с nj.gov: nj.gov.
- Дихромат натрия. Строительный блок для практически всех других соединений хрома. (2010-2012). Получено от elementis chromium: elementischromium.com
- K. Ahluwalia, R.A. (2004). Комплексная практическая органическая химия: препараты и количественный анализ. Дели: Университетская пресса (Индия).


