Структура, свойства, синтез и использование циклогексена
циклогексан представляет собой алкен или циклический олефин с молекулярной формулой C6H10. Он состоит из бесцветной жидкости, не растворим в воде и смешивается со многими органическими растворителями. Он характеризуется тем, что является легковоспламеняющимся, и в природе его обычно можно найти в каменноугольной смоле..
Циклогексен синтезируется путем частичного гидрирования бензола и дегидратации спирта циклогексанолом; то есть более ржавая форма. Как и другие циклоалкены, он подвергается реакциям электрофильного присоединения и со свободными радикалами; например, реакция галогенирования.
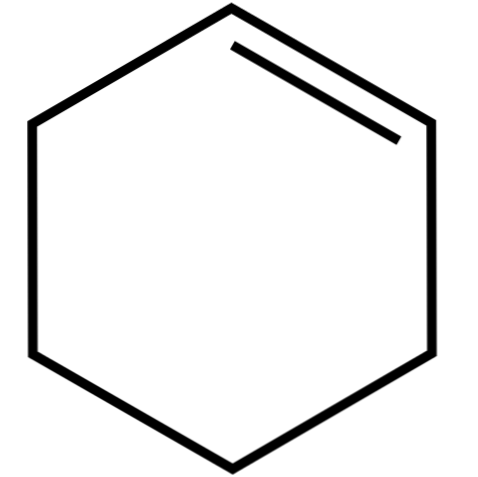
Этот циклический алкен (верхнее изображение) образует азеотропные смеси (не отделяемые дистилляцией) с низшими спиртами и уксусной кислотой. Он не очень стабилен при длительном хранении, так как разлагается под действием солнечного света и ультрафиолетового излучения..
Циклогексен используется в качестве растворителя и, следовательно, имеет множество применений, таких как: стабилизатор высокооктановых бензинов и для экстракции масел.
Но самое главное, что циклогексен служит промежуточным продуктом и сырьем для производства многих полезных соединений, среди которых: циклогексанон, адипиновая кислота, малеиновая кислота, циклогексан, бутадиен, циклогексилкарбоновая кислота и т. Д..
индекс
- 1 Структура циклогексена
- 1.1 Межмолекулярные взаимодействия
- 2 свойства
- 2.1 Химические названия
- 2.2 Молекулярный вес
- 2.3 Внешность
- 2,4 Запах
- 2.5 Точка кипения
- 2.6 Точка плавления
- 2.7 Температура вспышки
- 2.8 Растворимость в воде
- 2.9 Растворимость в органических растворителях
- 2.10 Плотность
- 2.11 Плотность паров
- 2.12 Давление пара
- 2.13 Самовоспламенение
- 2.14 Разложение
- 2.15 Вязкость
- 2.16 Теплота сгорания
- 2.17 Тепло испарения
- 2.18 Поверхностное натяжение
- 2.19 Полимеризация
- 2.20 Порог запаха
- 2.21 Показатель преломления
- 2,22 рН
- 2.23 Стабильность
- 2.24 Реакции
- 3 Резюме
- 4 использования
- 5 рисков
- 6 Ссылки
Структура циклогексена
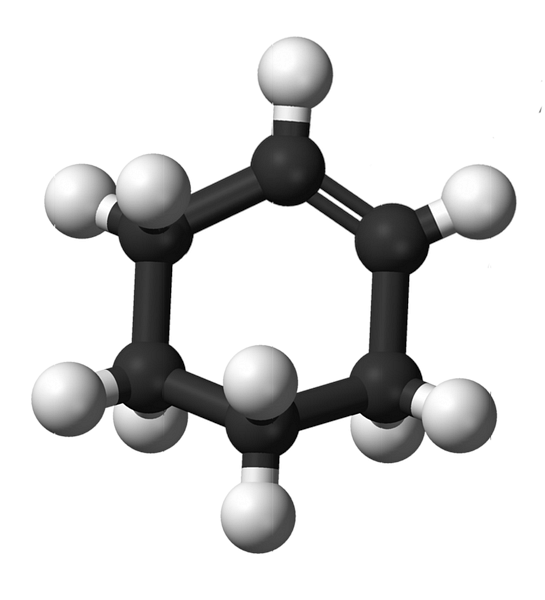
Структура циклогексена с моделью сфер и стержней показана на изображении выше. Можно заметить шесть углеродных колец и двойную связь, обе ненасыщенности соединения. С этой точки зрения кажется, что кольцо плоское; но это совсем не так.
Для начала, атомы углерода двойной связи имеют sp-гибридизацию2, что дает им геометрию тригональной плоскости. Следовательно, эти два атома углерода и те, которые примыкают к ним, находятся в одной плоскости; в то время как два атома углерода на противоположном конце (к двойной связи) находятся выше и ниже указанной плоскости.
Нижнее изображение прекрасно иллюстрирует только что объясненное.

Обратите внимание, что черная полоса состоит из четырех атомов углерода: два из двойной связи, а другие прилегающие к ним. Открытая перспектива - это та, которая была бы получена, если бы зритель поместил свой глаз прямо перед двойной связью. Тогда видно, что углерод находится выше и ниже этой плоскости..
Поскольку молекула циклогексена не является статичной, два атома углерода будут обмениваться: один будет опускаться, а другой подниматься над плоскостью. Таким образом, вы ожидаете, что эта молекула будет вести себя.
Межмолекулярные взаимодействия
Циклогексен является углеводородом, и поэтому его межмолекулярные взаимодействия основаны на дисперсионных силах Лондона.
Это связано с тем, что молекула является неполярной, без постоянного дипольного момента, и ее молекулярный вес является фактором, который в наибольшей степени способствует сохранению ее когезии в жидкости..
Кроме того, двойная связь увеличивает степень взаимодействия, поскольку она не может двигаться с такой же гибкостью, как у других атомов углерода, и это способствует взаимодействию между соседними молекулами. По этой причине циклогексен имеет немного более высокую температуру кипения (83 ° C), чем циклогексан (81 ° C)..
свойства
Химические названия
Циклогексен, тетрагидробензол.
Молекулярный вес
82,146 г / моль.
Внешний вид
Бесцветная жидкость.
запах
Сладкий запах.
Точка кипения
От 83 ºC до 760 мм рт.ст..
Точка плавления
-103,5 ºC.
Точка зажигания
-7ºC (закрытая чашка).
Растворимость в воде
Фактически нерастворимый (213 мг / л).
Растворимость в органических растворителях
Смешивается с этанолом, бензолом, четыреххлористым углеродом, петролейным эфиром и ацетоном. Ожидается, что он сможет растворять неполярные соединения, подобно некоторым аллотропам угля.
плотность
0,810 г / см3 при 20ºC.
Плотность пара
2,8 (относительно воздуха, принятого равным 1).
Давление пара
89 мм рт.ст. при 25ºC.
Самовоспламенение
244 ºC.
разложение
Разлагается в присутствии солей урана, под действием солнечного света и ультрафиолетового излучения.
вязкость
0,625 мПаскаль при 25 ºC.
Теплота сгорания
3751,7 кДж / моль при 25ºC.
Тепло испарения
30,46 кДж / моль при 25 ºC.
Поверхностное натяжение
26,26 мН / м.
полимеризация
Может полимеризоваться при определенных условиях..
Порог запаха
0,6 мг / м3.
Показатель преломления
1,4465 при 20 ºC.
pH
7-8 при 20ºC.
стабильность
Циклогексен не очень стабилен при длительном хранении. Воздействие света и воздуха может привести к образованию пероксидов. Кроме того, он несовместим с сильными окислителями.
реакции
-Циклоалкены в основном испытывают реакции присоединения, как электрофильные, так и свободные радикалы.
-Реагирует с бромом с образованием 1,2-дибромциклогексана.
-Быстро окисляется в присутствии перманганата калия (KMnO4).
-Он способен производить эпоксид (циклогексеноксид) в присутствии пероксибензойной кислоты.
синтез
Циклогексен получают кислотным катализом циклогексанола:
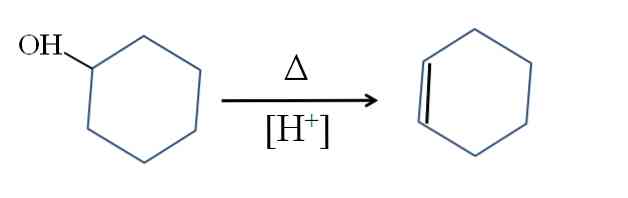
Символ Δ обозначает тепло, необходимое для ускорения выхода группы ОН в виде молекулы воды в кислой среде (-ОН2+).
Циклогексен также получают частичным гидрированием бензола; то есть две его двойные связи добавляют молекулу водорода:
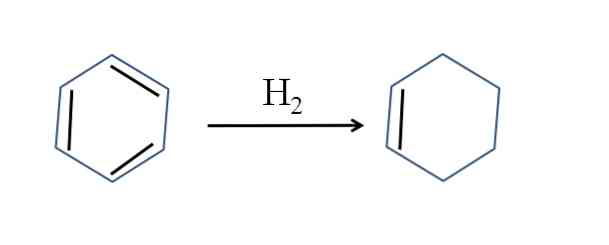
Хотя реакция кажется простой, она требует значительного давления H2 и катализаторы.
приложений
-Он полезен в качестве органического растворителя. Кроме того, он является сырьем для производства адипиновой кислоты, адипинового альдегида, малеиновой кислоты, циклогексана и циклогексилкарбоновой кислоты..
-Он используется в производстве циклогексана хлорида, соединения, используемого в качестве посредника в производстве фармацевтических продуктов и резиновых добавок..
-Циклогексен также используется в синтезе циклогексанона, сырья для производства лекарств, пестицидов, парфюмерии и красителей..
-Циклогексен участвует в синтезе аминоциклогексанола, соединения, которое используется в качестве поверхностно-активного вещества и эмульгатора..
-Кроме того, циклогексен может быть использован для приготовления в лаборатории бутадиена. Последний состав используется в производстве синтетического каучука, в производстве шин для автомобилей, а также в производстве акриловых пластиков..
-Циклогексен является сырьем для синтеза лизина, фенола, полициклоолефиновой смолы и резиновых добавок..
-Используется в качестве стабилизатора высокооктановых бензинов.
-Участвует в синтезе водостойких покрытий, трещиностойких пленок и связующих связующих для покрытий.
риски
Циклогексен не является очень токсичным соединением, но он может вызвать покраснение кожи и глаз при контакте. Его вдыхание может вызвать кашель и сонливость. Кроме того, его прием внутрь может вызвать сонливость, затруднение дыхания и тошноту.
Циклогексен плохо всасывается в желудочно-кишечном тракте, поэтому никаких серьезных системных эффектов при приеме внутрь не ожидается. Наибольшим осложнением является его аспирация дыхательной системой, которая может вызвать химическую пневмонию..
ссылки
- Джозеф Ф. Чан и Саймон Харви Бауэр. (1968). Молекулярная структура циклогексена. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Карри Барнс. (2019). Циклогексен: опасности, синтез и структура. Исследование. Получено с: study.com
- Моррисон, Р. Т. и Бойд, Р. Н. (1987). Органическая химия (5та Выпуск.). Редакция Аддисон-Уэсли Iberoamericana.
- PubChem. (2019). Циклогексена. Получено из: pubchem.ncbi.nlm.nih.gov
- Химическая Книга. (2019). Циклогексена. Получено с: chemicalbook.com
- Сеть токсикологических данных. (2017). Циклогексена. Toxnet. Получено от: toxnet.nlm.nih.gov
- Chemoxy. (Н.Д.). Структурная формула для циклогексена. Получено с: chemoxy.com


