Характерные свойства вещества (физические и химические)
характерные свойства вещества это химические или физические свойства, которые могут помочь идентифицировать или отличить одно вещество от другого. Физические свойства являются характеристиками вещества, которые наблюдаются с помощью чувств. Химические свойства - это характеристики, которые описывают, как вещество изменяется от одного вещества к другому во время химической реакции..
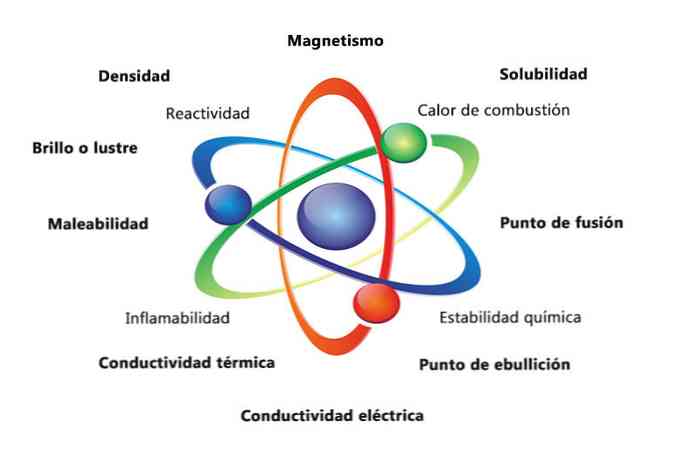
Некоторые физические свойства вещества - это плотность, растворимость, температура плавления, цвет и масса. Химические свойства материала включают воспламеняемость, химическую активность с кислотами и коррозию. Некоторые примеры того, как свойства вещества могут помочь идентифицировать элемент, - это сравнение плотности различных элементов..
Элемент, такой как золото, имеет плотность 19,3 грамма на кубический сантиметр, в то время как плотность серы составляет 1,96 грамма на кубический сантиметр. Аналогично, точки плавления таких веществ, как вода и изопропиловый спирт, различны..
Физические свойства вещества
Физические свойства вещества - это свойства, которые можно измерить или наблюдать без изменения химической природы вещества. Некоторые примеры физических свойств:
- Плотность: количество вещества, имеющего объект, рассчитывается путем деления массы на объем.
- Магнетизм: сила притяжения между магнитом и магнитным объектом.
- Растворимость: мера того, насколько хорошо вещество может раствориться в другом веществе.
- Точка плавления: температура, при которой вещество изменяется от твердого к жидкому.
- Точка кипения: температура, при которой вещество изменяется от жидкости к газу.
- Электропроводность: это мера того, насколько хорошо электрические токи движутся через вещество.
- Теплопроводность: скорость, с которой вещество передает тепло.
- Податливость: способность материала к прокатке или измельчению различными способами..
- Блеск или блеск: насколько легко объект отражает свет.
Химические свойства вещества
Химические свойства описывают способность вещества превращаться в новое вещество с другими свойствами. Ниже приведены несколько примеров химических свойств:
- Теплота сгорания: энергия, выделяемая при полном сгорании соединения с кислородом.
- Химическая стабильность: относится к тому, будет ли соединение реагировать с водой или воздухом (химически стабильные вещества не будут реагировать).
- Воспламеняемость: способность соединения гореть при воздействии пламени..
- Реакционная способность: способность взаимодействовать с другим веществом и образовывать одно или несколько новых веществ.
Физические состояния материи
Материя - это все, что занимает пространство, имеет массу и может быть воспринято нашими чувствами. Материя может быть классифицирована по физическому состоянию: твердое, жидкое и газообразное..
1- Твердые вещества и их характерные свойства
Все твердые тела имеют массу, занимают пространство, имеют определенный объем и форму, не проскальзывают через пространство и не могут быть сжаты или имеют жесткую форму. В качестве примеров мы приводим: дерево, книги, губки, металл, камни и т. Д..
В твердых телах мелкие частицы вещества очень близко друг к другу и касаются друг друга. Частицы настолько близко друг к другу, что они не могут много двигаться, между ними очень мало места.
2- Жидкости и их характерные свойства
Все жидкости имеют массу, занимают пространство, имеют определенный объем, но не определенной формы (поскольку они адаптируются к контейнеру, в котором они находятся), они могут быть сжаты в очень небольшой степени и могут скользить в пространстве. В качестве примеров у нас есть: вода, керосин, масло и т. Д..
В жидкостях маленькие частицы материи находятся немного дальше друг от друга, между ними больше пространства (по сравнению с твердыми телами), и они не касаются друг друга. Следовательно, частицы могут перемещаться между пространствами, толкаясь и сталкиваясь с другими частицами, постоянно меняя направление.
3- Газы и их характерные свойства
Все газы имеют массу, занимают пространство, не имеют определенного объема или формы, могут быть сильно сжаты и могут диффундировать в пространство. В качестве примеров мы имеем: водород, кислород, азот, углекислый газ, пар и т. Д..
В газах мелкие частицы вещества находятся намного дальше друг от друга, между ними гораздо больше пространства (по сравнению с жидкостями), и они не касаются друг друга. Частицы имеют максимальную свободу движения, поэтому они сталкиваются с другими частицами, постоянно меняя направление.
Изменения состояния материи
Материя может быть переведена из твердого состояния в жидкое состояние и наоборот, а из жидкого состояния в газообразное состояние и наоборот. Это преобразование берет имя изменения состояния вещества и происходит изменениями температуры:
слияние
Изменение состояния материала от твердого до жидкого за счет повышения температуры. Когда твердое вещество нагревается, тепло заставляет частицы вибрировать более энергично.
Достигнув точки плавления, твердые частицы имеют достаточную кинетическую энергию, чтобы преодолеть энергетические силы притяжения, которые удерживают их в фиксированных положениях, и они разрушаются, образуя небольшие группы жидких частиц..
Кипение или испарение
Изменение состояния жидкого вещества на газообразное за счет повышения температуры. Когда жидкое вещество нагревается, тепло заставляет частицы двигаться еще быстрее.
Достигнув точки кипения, жидкие частицы обладают достаточной кинетической энергией, чтобы преодолеть силы притяжения, которые удерживают их в фиксированных положениях и разделяют на отдельные газообразные частицы..
Замораживание или затвердевание
Изменение состояния жидкого вещества в твердое с помощью понижения температуры. Когда жидкое вещество охлаждается, его частицы теряют много кинетической энергии. При достижении точки замерзания частицы перестают двигаться и вибрируют в фиксированном положении, превращаясь в твердые частицы.
Разжижение или конденсация
Изменение состояния газообразного вещества в жидкость за счет снижения температуры. Когда газообразное вещество охлаждается, его частицы теряют много кинетической энергии, что заставляет их притягивать друг друга, превращаясь в жидкие частицы..
сублимация
Некоторые материалы переходят непосредственно из твердого состояния в газообразное или наоборот, не проходя через жидкое состояние. Когда эти твердые вещества нагреваются, их частицы движутся так быстро, что полностью отделяются, образуя пар или газ, и наоборот, когда процесс происходит от газообразного до твердого вещества..
ссылки
- Де Подеста, М. Понимание свойств материи, 2-е издание. Великобритания: Тейлор и Фрэнсис.
- Гоэль А. Состояния материи. Нью-Дели: Издательство Discovery.
- Мур Дж., Станицкий С. Молекулярная наука, 5-е издание. Стэмфорд.
- Рамакришна А. Природа материи, 1-е издание. Нью-Дели: Братья Гоял Пракашан.
- Reger D, Goode S, Ball D. Химия. Принципы и практика, 3-е издание. Канада: Брукс / Коул, Cengage Learning.
- Шапере Д. Материя (физика). Получено с: accessscience.com.
- Сингх Л, Каур М. Материя в нашем окружении. Индия: школа С. Чанда.


