Характеристики, функции, типы и ингибиторы топоизомераз
топоизомеразы являются типом изомеразных ферментов, которые модифицируют топологию дезоксирибонуклеиновой кислоты (ДНК), вызывая как ее разматывание, так и намотку и суперскручение.
Эти ферменты играют специфическую роль в снятии крутильного напряжения в ДНК, так что могут происходить важные процессы, такие как ее репликация, транскрипция ДНК в мессенджере рибонуклеиновой кислоты (мРНК) и рекомбинация ДНК..

Ферменты топоизомеразы присутствуют как в эукариотических, так и в прокариотических клетках. Его существование было предсказано учеными Уотсоном и Криком при оценке ограничений, представленных структурой ДНК для обеспечения доступа к ее информации (хранящейся в ее нуклеотидной последовательности)..
Чтобы понять функции топоизомераз, необходимо учитывать, что ДНК имеет стабильную структуру двойной спирали, и ее цепи катятся одна над другой..
Эти линейные цепи состоят из 2-дезоксирибозы, соединенной фосфодиэфирными связями 5'-3 ', и азотистых оснований внутри их, как ступени винтовой лестницы.

Топологическое исследование молекул ДНК показало, что они могут принимать несколько конформаций в зависимости от их крутильного напряжения: от расслабленного состояния до различных состояний обмотки, которые позволяют их уплотнение.
Молекулы ДНК с различными конформациями называются топоизомерами. Таким образом, можно сделать вывод, что топоизомеразы I и II могут увеличивать или уменьшать крутильное натяжение молекул ДНК, образуя их разные топоизомеры.
Среди возможных топоизомеров ДНК наиболее распространенной конформацией является суперскручение, которое является очень компактным. Однако двойная спираль ДНК также должна быть развернута топоизомеразами во время нескольких молекулярных процессов..
индекс
- 1 Характеристики
- 1.1 Механизм общего действия
- 1.2 Топоизомеразы и клеточный цикл
- 2 функции
- 2.1 Компактное хранение генетического материала
- 2.2 Доступ к генетической информации
- 2.3 Регуляция экспрессии генов
- 2.4 Особенности топоизомеразы II
- 3 типа топоизомераз
- 3.1-Топоизомеразы типа I
- 3.2 -Топоизомеразы типа II
- 3.3 - Топоизомеразы человека
- 4 ингибитора топоизомеразы
- 4.1-Топоизомеразы как мишени для химической атаки
- 4.2-Типы торможения
- 4.3 - Препараты ингибитора топоизомеразы
- 5 ссылок
черты
Механизм общего действия
Некоторые топоизомеразы могут расслаблять только отрицательные суперскрутки ДНК или обе суперскрутки ДНК: положительные и отрицательные.
Если кольцевая двухцепочечная ДНК разматывается по своей продольной оси и происходит поворот левой рукой (по часовой стрелке), говорят, что она имеет суперскрученную отрицательную спираль. Если поворот идет по часовой стрелке (против часовой стрелки), он имеет положительный супер-спиральный.

В основном топоизомеразы могут:
-Облегчить прохождение нити ДНК через разрез в противоположной нити (топоизомераза типа I).
-Облегчить прохождение полной двойной спирали через расщепление внутри себя или через расщепление в другой другой двойной спирали (топоизомераза типа II).
Таким образом, топоизомеразы действуют через расщепление фосфодиэфирных связей в одной или обеих цепях, которые составляют ДНК. Затем измените состояние намотки нитей двойной спирали (топоизомераза I) или двух двойных спиралей (топоизомераза II), чтобы, наконец, вернуться, чтобы связать или лигировать концы, вырезанные.
Топоизомеразы и клеточный цикл
Хотя топоизомераза I является ферментом, который проявляет большую активность во время S-фазы (синтез ДНК), он не считается зависимым от фазы клеточного цикла.
В то время как активность топоизомеразы II является более активной во время логарифмической фазы роста клеток и в клетках быстрорастущих опухолей.
функции
Изменение генов, кодирующих топоизомеразы, является летальным для клеток, демонстрируя важность этих ферментов. Среди процессов, в которых участвуют топоизомеразы:
Компактное хранение генетического материала
Топоизомеразы облегчают компактное хранение генетической информации, поскольку они генерируют спираль ДНК и суперскрученную, позволяя найти большое количество информации в относительно небольшом объеме..
Доступ к генетической информации
Если бы не было топоизомераз и их уникальных характеристик, было бы невозможно получить доступ к информации, хранящейся в ДНК. Это связано с тем, что топоизомеразы периодически снимают напряжение путем скручивания, которое образуется в двойной спирали ДНК, во время ее разматывания, в процессах репликации, транскрипции и рекомбинации..

Если напряжение, вызванное кручением, возникающим во время этих процессов, не будет снято, это может привести к дефектной экспрессии гена, нарушению циркулярной ДНК или хромосомы, даже вызывая гибель клеток..
Регуляция экспрессии генов
Конформационные изменения (в трехмерной структуре) молекулы ДНК обнажают определенные области снаружи, которые могут взаимодействовать с ДНК-связывающими белками. Эти белки имеют регуляторную функцию экспрессии генов (положительную или отрицательную).
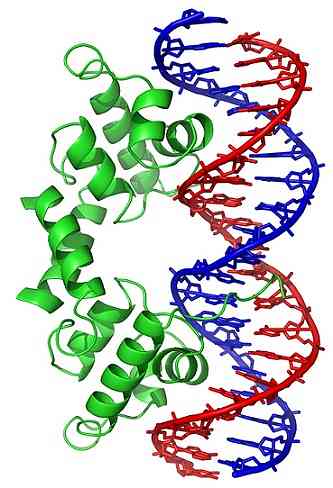
Таким образом, состояние обмотки ДНК, генерируемой действием топоизомераз, влияет на регуляцию экспрессии генов.
Особенности топоизомеразы II
Топоизомераза II необходима для сборки хроматид, конденсации и деконденсации хромосом и сегрегации дочерних молекул ДНК во время митоза.
Этот фермент также является структурным белком и одним из основных компонентов матрицы клеточного ядра во время интерфазы.
Типы топоизомераз
Существует два основных типа топоизомераз в зависимости от того, способны ли они расщеплять одну или две цепи ДНК.
-Топоизомеразы типа I
мономерный
Топоизомеразы типа I представляют собой мономеры, которые смягчают отрицательные и положительные суперкатушки, которые образуются при перемещении вилки во время транскрипции, а также во время процессов репликации и рекомбинации генов..
Топоизомеразы типа I можно подразделить на тип 1А и тип 1В. Последние обнаружены у людей и отвечают за расслабление суперскрученной ДНК..
Тирозин в своем активном сайте
Топоизомераза 1B (Top1B) состоит из 765 аминокислот, разделенных на 4 специфических домена. Один из этих доменов имеет высоко консервативную область, которая содержит активный сайт с тирозином (Tyr7233). Все топоизомеразы присутствуют в своем активном сайте тирозина с фундаментальной ролью во всем каталитическом процессе.
Механизм действия
Тирозин из активного сайта образует ковалентную связь с 3'-фосфатным концом цепи ДНК, обрезая его и удерживая его прикрепленным к ферменту, пропуская другую цепь ДНК через иссечение.
Прохождение другой цепи ДНК через вырезанную цепь достигается благодаря конформационному превращению фермента, которое вызывает раскрытие двойной спирали ДНК..
Затем топоизомераза I возвращается к своей первоначальной конформации и снова связывает вырезанные концы. Это происходит в результате процесса, обратного разрыву цепи ДНК в каталитическом сайте фермента. Наконец, топоизомераза высвобождает цепь ДНК.
Скорость лигирования ДНК выше, чем скорость удаления, что обеспечивает стабильность молекулы и целостность генома.
Таким образом, топоизомераза типа I катализирует:
- Иссечение нити.
- Прохождение другой нити через сплит.
- Лигирование секущихся концов.
-Топоизомеразы типа II
димерная
Топоизомеразы типа II представляют собой димерные ферменты, которые расщепляют обе цепи ДНК, таким образом расслабляя суперскрутки, которые генерируются во время транскрипции и других клеточных процессов..
Mg зависимых++ и спс
Этим ферментам нужен магний (Mg++) и также нуждаются в энергии, которая исходит от разрыва АТФ-трифосфатной связи, которой они пользуются благодаря АТФазе.
Два активных сайта с тирозином
Человеческие топоизомеразы II очень похожи на таковые у дрожжей (Saccharomyces cerevisiae), который состоит из двух мономеров (подфрагменты A и B). Каждый мономер имеет домен АТФазы и в субфрагменте активный сайт 782 тирозина, с которым может связываться ДНК. Следовательно, две цепи ДНК могут быть присоединены к топоизомеразе II..
Механизм действия
Механизм действия топоизомеразы II такой же, как описанный для топоизомеразы I, учитывая, что расщепляются две цепи ДНК, а не только одна.
В активном сайте топоизомеразы II фрагмент белка стабилизируется (посредством ковалентного связывания с тирозином). двойная спираль ДНК, называемый «фрагмент G». Этот фрагмент расщепляется и остается связанным с активным центром ковалентными связями.
Затем фермент позволяет другому фрагменту ДНК, называемому «фрагментом Т», проходить через расщепленный фрагмент «G» благодаря конформационному изменению фермента, которое зависит от гидролиза АТФ..
Топоизомераза II связывает два конца «фрагмента G» и, наконец, восстанавливает свое первоначальное состояние, высвобождая фрагмент «G». Затем ДНК ослабляет крутильное напряжение, позволяя происходить процессам репликации и транскрипции..
-Топоизомеразы человека
Геном человека имеет пять топоизомераз: top1, top3α, top3β (типа I); и top2α, top2β (типа II). Наиболее релевантными человеческими топоизомеразами являются топ1 (топоизомераза типа IB) и 2α (топоизомераза типа II).
Ингибиторы топоизомеразы
-Топоизомеразы как мишени для химической атаки
Поскольку процессы, катализируемые топоизомеразами, необходимы для выживания клеток, эти ферменты являются хорошими мишенями для воздействия на злокачественные клетки. Для этого топоизомеразы считаются важными в лечении многих заболеваний человека.
Препараты, которые взаимодействуют с топоизомеразами, в настоящее время широко изучаются как химиотерапевтические вещества против раковых клеток (в разных органах организма) и патогенных микроорганизмов..
-Типы торможения
Препараты, ингибирующие активность топоизомеразы, могут:
- Впитывать в ДНК.
- Влияют на фермент топоизомеразы.
- Чередование с молекулой рядом с активным центром фермента, в то время как комплекс ДНК-топоизомераза стабилизируется.
Стабилизация временного комплекса, который образуется при связывании ДНК с тирозином каталитического сайта фермента, предотвращает объединение вырезанных фрагментов, что может привести к гибели клеток.
-Ингибиторы топоизомераз
Среди соединений, которые ингибируют топоизомеразы, являются следующие.
Противоопухолевые антибиотики
Антибиотики используются против рака, так как они предотвращают рост опухолевых клеток, обычно путем воздействия на их ДНК. Их часто называют противоопухолевыми антибиотиками (против рака). Например, актиномицин D влияет на топоизомеразу II и используется при опухолях Вильмса у детей и при рабдомиосаркомах..
антрациклинов
Антрациклины, среди антибиотиков, являются наиболее эффективными противораковыми препаратами и имеют самый широкий спектр. Они используются при лечении рака легких, яичников, матки, желудка, мочевого пузыря, молочной железы, лейкемии и лимфом. Известно, что он влияет на топоизомеразу II путем интеркаляции в ДНК.
Первый антрациклин, выделенный из актинобактерий (Streptomyces peucetius) был даунорубицин Впоследствии доксорубицин был синтезирован в лаборатории, и теперь также используются эпирубицин и идарубицин..
антрахинона
Антрахиноны или антрацендионы представляют собой соединения, полученные из антрацена, аналогичные антрациклинам, которые влияют на активность топоизомеразы II путем интеркаляции в ДНК. Они используются для лечения метастатического рака молочной железы, неходжкинской лимфомы (НХЛ) и лейкемии..
Эти препараты были обнаружены в пигментах некоторых насекомых, растений (frángula, сенна, ревень), лишайниках и грибах; а также в hoelita, который является природным минералом. В зависимости от их дозы они могут быть канцерогенными.
Среди этих соединений у нас есть митоксантрон и его аналог лосоксантрон. Они предотвращают размножение клеток злокачественной опухоли, необратимое связывание с ДНК.
эпиподофиллотоксины
Подофиллотоксины, такие как эпидофилотоксины (VP-16) и тенипозид (VM-26), образуют комплекс с топоизомеразой II. Они используются против рака легких, яичек, лейкемии, лимфом, рака яичников, рака молочной железы и злокачественных внутричерепных опухолей, среди других. Они изолированы от растений Podophyllum notatum и P. peltatum.
Аналоги камптотецинов
Кампотецины представляют собой соединения, которые ингибируют топоизомеразу I, и среди них - иринотекан, топотекан и дифломотекан..
Эти соединения были использованы против рака толстой кишки, легких и молочной железы и получены естественным путем из коры и листьев древесных пород. Camptotheca acuminata китайских персиков и тибета.
Естественное торможение
Структурные изменения топоизомераз I и II также могут происходить совершенно естественно. Это может произойти во время некоторых событий, которые влияют на его каталитический процесс.
Среди этих изменений можно отметить образование димеров пиримидина, несоответствия азотистых оснований и другие события, вызванные окислительным стрессом..
ссылки
- Anderson, H. & Roberge, M. (1992). ДНК-топоизомераза II: обзор ее участия в структуре хромосом, репликации ДНК, транскрипции и митозе. Cell Biology International Reports, 16 (8): 717-724. doi: 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N. & Salgia, R. (2006). Обзор ингибирования топоизомеразы при раке легких. Рак биологии и терапии, 5 (12): 1600-1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S.C.F. & To, K.K.W. (2003). Противораковые агенты на основе платины: инновационные стратегии проектирования и биологические перспективы. Medicinal Research Reviews, 23 (5): 633-655. дои: 10.1002 / мед.10038
- Li, T.-K. & Liu, L.F. (2001). Гибель опухолевых клеток, индуцированная препаратами, нацеленными на топоизомеразу. Ежегодный обзор фармакологии и токсикологии, 41 (1): 53-77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Лю, Л. Ф. (1994). ДНК-топоизомеразы: препараты, нацеленные на топоизомеразу. Академическая пресса. 307 стр.
- Osheroff, N. and Bjornsti, M. (2001). ДНК-топоизомераза. Энзимология и наркотики. Том II. Humana Press. С. 329.
- Ротенберг, М. Л. (1997). Ингибиторы топоизомеразы I: обзор и обновление. Анналы онкологии, 8 (9), 837-855. doi: 10.1023 / a: 1008270717294
- Райан Б. (2009, 14 декабря). Топоизомераза 1 и 2. [Видео файл]. Получено с youtube.com


