Характеристики и ограничения атомной модели Бройля
Атомная модель Бройля был предложен французским физиком Луи Бройлем в 1924 году. В своей докторской диссертации Бройль утверждал, что электронно-волновое дуальность электронов закладывает основы волновой механики. Бройль опубликовал важные теоретические выводы о корпускулярно-волновой природе вещества в атомном масштабе..
Впоследствии утверждения Бройля были экспериментально продемонстрированы учеными Клинтоном Дэвиссоном и Лестером Джермером в 1927 году. Теория электронных волн Бройля основана на предложении Эйнштейна о волновых свойствах света на коротких длинах волн..
Брогли объявил о возможности поведения вещества, подобного поведению света, и предложил аналогичные свойства в субатомных частицах, таких как электроны..
Электрические заряды и орбиты ограничивают амплитуду, длину и частоту волны, описываемой электронами. Бройль объяснил движение электронов вокруг атомного ядра.
индекс
- 1 Характеристики атомной модели Бройля
- 2 Эксперимент Дэвиссона и Гермера
- 3 ограничения
- 4 Статьи интересов
- 5 ссылок
Характеристики атомной модели Бройля
Чтобы развить свое предложение, Бройль исходил из принципа, что электроны имеют двойственную природу между волной и частицей, подобно свету..
В этом смысле Бройль провел сравнение между обоими явлениями и, основываясь на уравнениях, разработанных Эйнштейном для изучения волновой природы света, указал следующее:
- Полная энергия фотона и, следовательно, полная энергия электрона, являются результатом произведения частоты волны и постоянной Планка (6.62606957 (29) × 10 -34 Жюль х секунд), как указано в следующем выражении:
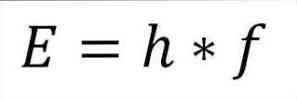
В этом выражении:
E = энергия электрона.
h = постоянная планки.
f = частота волны.
- Линейный момент фотона, а следовательно, и электрона, обратно пропорционален длине волны, и обе величины связаны через постоянную Планка:
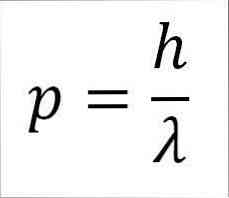
В этом выражении:
р = линейный момент электрона.
h = постоянная планки.
λ = длина волны.
- Линейный импульс представляет собой произведение массы частицы на скорость, которую частица имеет при перемещении.
Если предыдущее математическое выражение реструктурируется как функция длины волны, мы имеем следующее:
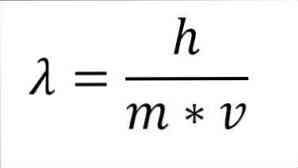
В указанном выражении:
λ = длина волны.
h = постоянная планки.
m = масса электрона.
v = скорость электрона.
Поскольку h, постоянная Планка, имеет небольшое значение, длина волны λ также. Следовательно, можно утверждать, что волновые свойства электрона проявляются только на атомном и субатомном уровнях..
- Бройль также основан на постулатах атомной модели Бора. Согласно последним, орбиты электронов ограничены и могут быть только кратными целым числам. таким образом:
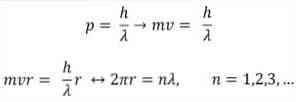
где:
λ = длина волны.
h = постоянная планки.
m = масса электрона.
v = скорость электрона.
r = радиус орбиты.
n = целое число.
Согласно атомной модели Бора, которую Брогли принял за основу, если электроны ведут себя как стоячие волны, единственными допустимыми орбитами являются те, радиус которых равен целому кратному длине волны λ.
Поэтому не все орбиты соответствуют параметрам, необходимым для того, чтобы электрон проходил через них. Вот почему электроны могут путешествовать только по определенным орбитам.
Волновая теория электронов Бройля обосновала успех атомной модели Бора для объяснения поведения одиночного электрона атома водорода..
Аналогично, это также пролило свет на то, почему эта модель не подходит для более сложных систем, то есть атомов с более чем одним электроном..
Эксперимент Дэвиссона и Гермера
Экспериментальная проверка атомной модели Брогли состоялась через 3 года после ее публикации, в 1927 году..
Выдающиеся американские физики Клинтон Дж. Дэвиссон и Лестер Гермер экспериментально подтвердили теорию волновой механики.
Дэвиссон и Гермер провели тесты рассеяния электронного пучка на кристалле никеля и наблюдали явление дифракции в металлической среде..
Проведенный эксперимент состоял из проведения следующей процедуры:
- В первом случае была размещена сборка с электронным пучком, которая имела известную начальную энергию.
- Источник напряжения был установлен, чтобы ускорить движение электронов, вызывая разность потенциалов.
- Поток электронного пучка был направлен к металлическому кристаллу; в этом случае никель.
- Было измерено количество электронов, которые воздействовали на кристалл никеля..
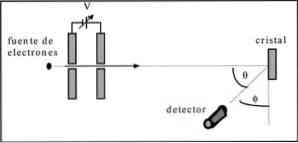
В конце эксперимента Дэвиссон и Гермер обнаружили, что электроны были распределены в разных направлениях..
Повторяя эксперимент с использованием металлических кристаллов с различной ориентацией, ученые обнаружили следующее:
- Дисперсия электронного пучка через металлический кристалл была сравнима с явлением интерференции и дифракции световых лучей..
- Отражение электронов на ударном кристалле описало траекторию, которую, теоретически, следует описать в соответствии с теорией электронных волн Бройля.
В синтезе эксперимент Дэвиссона и Гермера экспериментально доказал двойственную волновую-электронную природу электронов.
ограничения
Модель атома Брогли не предсказывает точное местоположение электрона на орбите, по которой он движется.
В этой модели электроны воспринимаются как волны, которые движутся по орбите без определенного местоположения, что вводит понятие электронной орбитали.
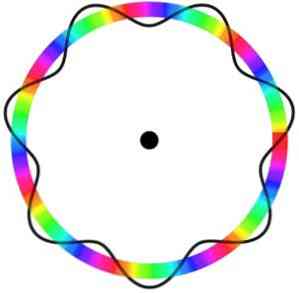
Кроме того, модель атома Бройля, аналогичная модели Шредингера, не учитывает вращение электронов вокруг своей оси (спин).
Игнорируя внутренний момент импульса электронов, пространственные изменения этих субатомных частиц игнорируются..
В том же порядке идей, эта модель не учитывает изменения в поведении быстрых электронов в результате релятивистских эффектов.
Статьи интереса
Атомная модель Шредингера.
Атомная модель Чедвика.
Атомная модель Гейзенберга.
Атомная модель Перрина.
Атомная модель Томсона.
Атомная модель Далтона.
Атомная модель Дирака Джордана.
Атомная модель Демокрита.
Атомная модель Бора.
ссылки
- Квантовая теория Бора и волны де Бройля (s.f.). Получено из: ne.phys.kyushu-u.ac.j
- Луи де Бройль - Биография (1929). © Нобелевский фонд. Получено с: nobelprize.org
- Луи-Виктор де Бройль (ср.) Получено от: chemed.chem.purdue.edu
- Ловетт Б. (1998). Луи де Бройль. Encyclopædia Britannica, Inc. Получено с: britannica.com
- Атомная модель де Бройля. Национальный университет дистанционного образования. Испания. Получено от: ocw.innova.uned.es
- Волны Материи Луи Де Бройля (s.f.). Получено от: hiru.eus
- Von Pamel O. и Marchisio S. (s.f.). Квантовая механика Национальный университет Росарио. Получено от: fceia.unr.edu.ar


