Энергия химической активации, из чего она состоит, расчет
энергия химической активации (с точки зрения кинетических исследований) относится к минимально возможному количеству энергии, необходимой для начала химической реакции. Согласно теории столкновений в химической кинетике, говорят, что все молекулы, которые находятся в движении, имеют определенное количество кинетической энергии..
Это означает, что чем больше скорость вашего движения, тем больше величина вашей кинетической энергии. В этом смысле молекула, которая несет быстрое движение, не может быть разделена на фрагменты сама по себе, поэтому между ней и другой молекулой должно произойти столкновение, чтобы произошла химическая реакция.
Когда это происходит - когда происходит столкновение между молекулами - часть его кинетической энергии преобразуется в энергию колебаний. Аналогичным образом, если в начале процесса кинетическая энергия высока, молекулы, участвующие в столкновении, будут представлять вибрацию настолько сильную, что некоторые из присутствующих химических связей будут разрушены..
Это нарушение связей является первым шагом в превращении реагентов в продукты; то есть в формировании этих. С другой стороны, если в начале этого процесса кинетическая энергия имеет небольшую величину, будет наблюдаться явление «отскока» молекул, посредством которого они будут практически неповрежденными..
индекс
- 1 Из чего он состоит??
- 1.1 Активированный комплекс
- 2 Как рассчитывается?
- 2.1 Расчет энергии активации химической реакции
- 3 Как энергия активации влияет на скорость реакции?
- 4 Примеры расчета энергии активации
- 5 ссылок
Из чего он состоит??
Исходя из концепции столкновений между молекулами для инициирования химических реакций, описанных ранее, можно сказать, что для возникновения столкновения требуется минимальное количество энергии.
Таким образом, если значение энергии меньше этого необходимого минимума, после столкновения просто не будет изменений между молекулами, что означает, что когда эта энергия отсутствует, участвующие виды остаются практически нетронутыми и не произойдут любые изменения из-за этого шока.
В этом порядке идей минимальная энергия, необходимая для того, чтобы изменение произошло после столкновения между молекулами, называется энергией активации..
Другими словами, молекулы, вовлеченные в удар, должны иметь общее количество кинетической энергии с величиной, равной или большей, чем энергия активации, чтобы могла происходить химическая реакция..
Кроме того, во многих случаях молекулы сталкиваются и порождают новый вид, называемый активированным комплексом, структура, которая также называется «переходным состоянием», потому что она существует только временно.
Это вызвано разновидностями реагента из-за столкновения и до образования продуктов реакции.
Активированный комплекс
Активированный комплекс, упомянутый выше, образует вид, который имеет очень низкую стабильность, но который, в свою очередь, имеет большое количество потенциальной энергии.
На следующей диаграмме показано преобразование реагентов в продукты, выраженное в терминах энергии и отмечающее, что величина энергии образующегося активированного комплекса значительно больше, чем энергия реагентов и продуктов..
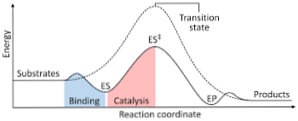
Если в конце реакции продукты имеют большую стабильность, чем реагентные вещества, выделение энергии происходит в виде тепла, что приводит к экзотермической реакции..
Напротив, если реагенты приводят к стабильности большей величины, чем продукты, это означает, что реакционная смесь проявляет поглощение энергии в форме тепла из окружающей среды, что приводит к эндотермической реакции..
Аналогичным образом, если происходит тот или иной случай, должна быть построена диаграмма, такая как показанная ранее, на которой изображена потенциальная энергия системы, которая реагирует на ход или ход реакции..
Таким образом, получают изменения потенциальной энергии, которые происходят в процессе реакции, и реагенты превращаются в продукты..
Как рассчитывается?
Энергия активации химической реакции тесно связана с константой скорости этой реакции, а зависимость этой константы от температуры представлена уравнением Аррениуса:
k = Ae-Ea / RT
В этом выражении К представляет собой константу скорости реакции (которая зависит от температуры) и параметр он называется частотным фактором, и это мера частоты межмолекулярных столкновений.
Со своей стороны, и выражает основу серии натуральных логарифмов. Он возводится в степень, равную отрицательному коэффициенту энергии активации (Еа) между продуктом, полученным из газовой постоянной (R) и абсолютная температура (T) системы для рассмотрения.
Следует отметить, что частотный фактор можно рассматривать как постоянный в определенных реакционных системах в широком диапазоне температур..
Это математическое выражение первоначально предполагалось химиком голландского происхождения Якобусом Генриком ван'т Хоффом в 1884 году, но он придал ему научную обоснованность и интерпретировал его предпосылку - химик шведского происхождения Сванте Аррениус, в 1889 году.
Расчет энергии активации химической реакции
Уравнение Аррениуса указывает на прямую пропорциональность, которая существует между константой скорости реакции и частотой столкновений между молекулами..
Кроме того, это уравнение может быть представлено более удобным способом, применяя свойство натуральных логарифмов к каждой стороне уравнения, получая:
ln k = ln A - Ea / RT
При переупорядочении членов с целью получения уравнения линии (y = mx + b) достигается следующее выражение:
ln k = (- Ea / R) (1 / T) + ln A
Таким образом, при построении графика зависимости ln k от 1 / T мы получаем прямую линию, где ln k представляет координату y, (- A / R) представляет наклон линии (m), (1 / T) представляет координату x, а ln A представляет пересечение с осью ординат (b).
Как видно, наклон, полученный в результате этого расчета, равен значению -Ea / R. Это подразумевает, что, если желательно получить значение энергии активации с помощью этого выражения, следует выполнить простую очистку, в результате чего:
Ea = -mR
Здесь мы знаем значение m и R константа, равная 8,314 Дж / К · моль.
Как энергия активации влияет на скорость реакции?
При попытке получить изображение энергии активации ее можно рассматривать как барьер, который не позволяет реакции между молекулами с более низкой энергией.
Так как в обычной реакции происходит, что число молекул, которые могут реагировать, довольно велико, скорость - и, что эквивалентно, кинетическая энергия этих молекул - может быть очень переменной.
Обычно случается так, что только небольшое количество совокупности молекул, которые испытывают столкновение - те, которые имеют большую скорость движения - представляют достаточную кинетическую энергию, чтобы иметь возможность преодолеть величину энергии активации. Таким образом, эти молекулы способны и могут быть частью реакции.
Согласно уравнению Аррениуса, отрицательный знак, который предшествует коэффициенту между энергией активации и произведением газовой постоянной на абсолютную температуру, подразумевает, что постоянная скорости уменьшается по мере увеличения энергии активации, а также рост при повышении температуры.
Примеры расчета энергии активации
Чтобы рассчитать энергию активации путем построения графика, согласно уравнению Аррениуса, мы имеем, что константы скорости реакции разложения ацетальдегида были измерены при пяти различных температурах, и мы хотим определить энергию активации для реакции, которая выражается как:
СН3СНО (г) → СН4(г) + СО (г)
Данные пяти измерений следующие:
к (1 / М1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
Т (К): 700-730-760-790-810
Во-первых, чтобы решить эту неизвестную и определить энергию активации, мы должны построить график ln k vs 1 / T (y vs x), чтобы получить прямую линию и отсюда взять наклон и найти значение Ea, как объяснили.
При преобразовании данных измерений в соответствии с уравнением Аррениуса [ln k = (- Ea / R) (1 / T) + ln A] для y и x найдены следующие значения соответственно:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / Т (К-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Из этих значений и с помощью математического расчета наклона - либо в компьютере, либо в калькуляторе, с помощью выражения m = (Y2-и1) / (X2-X1) или используя метод линейной регрессии, получаем, что m = -Ea / R = -2,09 * 104 К. Итак:
Ea = (8,314 Дж / К · моль) (2,09 * 10)4 K)
= 1,74 * 105 = 1,74 * 102 кДж / моль
Для определения других энергий активации графическим способом проводится аналогичная процедура.
ссылки
- Wikipedia. (Н.Д.). Энергия активации. Получено с en.wikipedia.org
- Чанг, Р. (2007). Химия, девятое издание. Мексика: Макгроу-Хилл.
- Britannica, E. (s.f.). Энергия активации. Получено с сайта britannica.com
- Мур Дж. У. и Пирсон Р.Г. (1961). Кинетика и механизм. Получено из books.google.co.ve
- Kaesche, H. (2003). Коррозия металлов: физико-химические основы и актуальные проблемы. Получено из books.google.co.ve


