Процедура электролиза воды, методики, для чего она, домашний эксперимент
электролиз воды это разложение воды на ее элементарные составляющие под действием электрического тока. При этом водород и молекулярный кислород образуются на двух инертных поверхностях, H2 и O2. Эти две поверхности более известны под названием электродов.
Теоретически, объем Н2 образуется должен быть в два раза больше объема O2. Почему? Поскольку молекула воды имеет отношение H / O, равное 2, то есть два H для каждого кислорода. Это соотношение проверяется непосредственно с помощью его химической формулы H2О. Однако многие экспериментальные факторы влияют на полученные объемы.

Если электролиз проводят внутри труб, погруженных в воду (верхнее изображение), столб воды меньшей высоты соответствует водороду, поскольку на поверхности жидкости присутствует большее количество газа, оказывающего давление. Пузырьки окружают электроды и в конечном итоге поднимаются после истечения давления пара воды.
Обратите внимание, что трубки отделены друг от друга таким образом, что существует низкая миграция газов от одного электрода к другому. В низких масштабах это не представляет неизбежного риска; но в промышленных масштабах газовая смесь Н2 и O2 Это очень опасно и взрывоопасно.
По этой причине электрохимические ячейки, в которых проводится электролиз воды, очень дороги; им нужны конструкция и элементы, которые гарантируют, что газы никогда не смешиваются, выгодная подача тока, высокая концентрация электролитов, специальные электроды (электрокатализаторы) и механизмы для хранения H.2 произведенный.
Электрокатализаторы представляют собой трение и в то же время крылья для прибыльности электролиза воды. Некоторые состоят из оксидов благородных металлов, таких как платина и иридий, цены на которые очень высоки. Именно в этот момент исследователи объединяют усилия для разработки эффективных, стабильных и дешевых электродов..
Причиной этих усилий является ускорение образования О2, который дается на более низких скоростях по сравнению с H2. Это замедляется электродом, где образуется О2 как общее следствие, применение потенциала намного больше, чем необходимо (перенапряжение); что то же самое, чтобы снизить производительность и более высокие расходы.
индекс
- 1 Реакция электролиза
- 1.1 Полуклеточные реакции
- 2 Процедура
- 3 Техники
- 3.1 Электролиз щелочной водой
- 3.2 Электролиз с полимерной электролитической мембраной
- 3.3 Электролиз с твердыми оксидами
- 4 Какая польза от электролиза воды??
- 4.1 Производство водорода и его использование
- 4.2 Как метод отладки
- 4.3 Как поставка кислорода
- 5 Домашний эксперимент
- 5.1 Домашние переменные
- 6 Ссылки
Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
2H2O (l) => 2H2(г) + О2(G)
Как видно из уравнения, вмешиваются две молекулы воды: одну обычно нужно уменьшить или получить электроны, а другую - окислить или потерять электроны..
H2 Это продукт восстановления воды, потому что усиление электронов способствует протонов H+ может быть ковалентно связан, и кислород превращается в ОН-. Поэтому Н2 происходит на катоде, который является электродом, где происходит восстановление.
В то время как O2 происходит от окисления воды, потому что она теряет электроны, которые позволяют ей связываться с водородом, и, следовательно, высвобождает протоны H+. O2 происходит на аноде, электроде, где происходит окисление; и в отличие от другого электрода, pH вокруг анода является кислым, а не основным.
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
2H2O + 2e- => H2 + 2OH- (Катод, основной)
2H2O => O2 + 4H+ + 4e- (Анод, кислота)
Однако вода не может потерять больше электронов (4e-) из которых другая молекула воды побеждает на катоде (2e-); следовательно, первое уравнение должно быть умножено на 2, а затем вычтено со вторым уравнением, чтобы получить чистое уравнение:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + О2 + 4H+ + 4OH-
Но 4Н+ и 4OH- они образуют 4H2Или, таким образом, они устраняют четыре из шести молекул H2Или оставив два; и в результате глобальная реакция только что изложил.
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
процесс
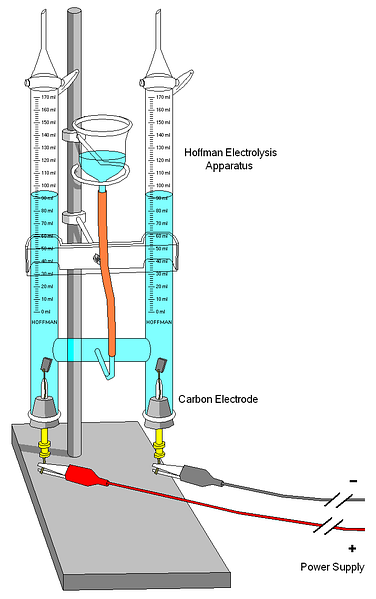
На верхнем изображении показан вольтметр Хоффмана. Цилиндры заполняются водой и выделенными электролитами через среднее сопло. Роль этих электролитов заключается в повышении проводимости воды, потому что в нормальных условиях очень мало ионов H3О+ и ОН- продукты вашего авто ионизации.
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
Электроны перемещаются по всему контуру, пока вы не достигнете другого электрода, где вода выигрывает и становится Н2 и ОН-. На данный момент анод и катод уже определены, которые могут быть дифференцированы по высоте водяных столбов; тот, который имеет меньшую высоту, соответствует катоду, где образуется Н2.
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
4H2O (l) + 4e- => 2H2(г) + 4ОН-(Aq)
4OH-(ac) => O2(г) + 2Н2O (l) + 4e-
Как видно, как на катоде, так и на аноде вода имеет основной pH; и кроме того, ОН- мигрировать на анод, где они окисляются до O2.
Электролиз с полимерной электролитической мембраной
В этой технике используется твердый полимер, который служит проницаемой мембраной для H+, но водонепроницаемый для газов. Это гарантирует большую безопасность при электролизе.
Полуклеточные реакции для этого случая:
4H+(ac) + 4e- => 2H2(G)
2H2O (l) => O2(г) + 4Н+(ac) + 4e-
Ионы Н+ они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Очень отличающийся от других методов, он использует оксиды в качестве электролитов, которые при высоких температурах (600-900ºC) функционируют в качестве среды переноса анионов.2-.
Реакции:
2H2O (г) + 4e- => 2H2(г) +202-
2O2- => O2(г) + 4е-
Обратите внимание, что на этот раз оксидные анионы, или2-, те, кто путешествует на анод.
Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
2NaCl + 2H2O => Cl2 + H2 + 2 NaOH,
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом..
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д. Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Домашний эксперимент
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Первый - это изменение pH воды с использованием уксуса для подкисления воды или Na.2Колорадо3 немного подвести Изменение количества наблюдаемых пузырьков должно произойти.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).
ссылки
- Wikipedia. (2018). Электролиз воды. Получено с: en.wikipedia.org
- Чаплин М. (16 ноября 2018 г.). Электролиз воды. Структура воды и наука. Получено с: 1.lsbu.ac.uk
- Энергоэффективность и возобновляемая энергия. (Н.Д.). Производство водорода: электролиз. Получено от: energy.gov
- Phys.org. (14 февраля 2018 г.) Высокоэффективный, недорогой катализатор для электролиза воды. Получено с: phys.org
- Химия LibreTexts. (18 июня 2015 г.) Электролиз воды. Получено от: chem.libretexts.org
- Сян С., М. Пападантонакисаб К. и С. Льюис Н. (2016). Принципы и реализации электролизных систем для вододеления. Королевское химическое общество.
- Регенты Университета Миннесоты. (2018). Электролиз воды 2. Университет Миннесоты. Получено из: chem.umn.edu


