Структура бикарбоната кальция, свойства, риски и использование
бикарбонат кальция неорганическая соль с химической формулой Ca (HCO)3)2. Это происходит в природе из карбоната кальция, присутствующего в известняковых породах и минералах, таких как кальцит.
Бикарбонат кальция более растворим в воде, чем карбонат кальция. Эта характеристика позволила сформировать карстовые системы в известняковых породах и в структурировании пещер..

Подземные воды, которые проходят через трещины, становятся насыщенными в результате вытеснения углекислого газа (СО2). Эти воды разрушают известняковые породы, выделяя карбонат кальция (СаСО3) который будет образовывать бикарбонат кальция в соответствии со следующей реакцией:
CaCO3(s) + CO2(г) + Н2O (l) => Ca (HCO)3)2(Aq)
Эта реакция происходит в пещерах, где происходит очень жесткая вода. Бикарбонат кальция находится не в твердом состоянии, а в водном растворе вместе с Са2+, бикарбонат (HCO)3-) и карбонат-ион (СО32-).
Впоследствии, когда насыщение диоксида углерода в воде уменьшается, происходит обратная реакция, то есть превращение бикарбоната кальция в карбонат кальция:
Ca (HCO)3)2(aq) => CO2 (г) + Н2O (l) + CaCO3 (S),
Карбонат кальция плохо растворим в воде, поэтому его осаждение происходит в виде твердого вещества. Вышеуказанная реакция очень важна при образовании сталактитов, сталагмитов и других образований в пещерах..
Эти скальные структуры сформированы из капель воды, которые падают с потолка пещер (верхнее изображение). CaCO3 присутствующие в каплях воды кристаллизуются с образованием упомянутых структур.
Тот факт, что бикарбонат кальция не обнаружен в твердом состоянии, затруднил его использование, и найдено несколько примеров. Кроме того, трудно найти информацию о его токсических эффектах. Имеется сообщение о совокупности побочных эффектов его применения в качестве средства профилактики остеопороза..
структура
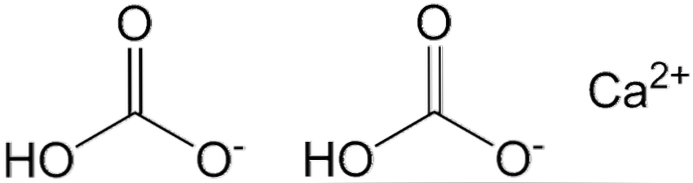
Два аниона HCO показаны на верхнем изображении3- и катион Ca2+ взаимодействуя электростатически. Ca2+ в соответствии с изображением, оно должно быть расположено посередине, поскольку именно так HCO3- они не будут отталкивать друг друга из-за своих отрицательных зарядов.
Отрицательный заряд в HCO3- он делокализован между двумя атомами кислорода путем резонанса между карбонильной группой C = O и связью C-O-; в то время как в СО32-, Это делокализовано между тремя атомами кислорода, так как связь С-ОН депротонирована и поэтому может получить отрицательный заряд по резонансу.
Геометрию этих ионов можно рассматривать как сферы кальция, окруженные плоскими треугольниками карбонатов с гидрированным концом. С точки зрения соотношения размеров, кальций заметно меньше, чем ионы HCO3-.
Водные растворы
Ca (HCO)3)2 Он не может образовывать кристаллические твердые вещества, и он действительно состоит из водных растворов этой соли. В них ионы не одни, как на изображении, а окружены молекулами H.2О.
Как они взаимодействуют? Каждый ион окружен сферой гидратации, которая будет зависеть от металла, полярности и структуры растворенных частиц.
Ca2+ координируется с атомами кислорода воды с образованием акокомплекса Ca (OH)2)N2+, где n обычно считается равным шести; то есть «водный октаэдр» вокруг кальция.
Пока HCO анионы3- взаимодействовать с водородными связями (ИЛИ2СО-Н-ОН2) или с атомами водорода в воде в направлении отрицательного заряда делокализует (HOCO)2- H-OH, диполь-ионное взаимодействие).
Эти взаимодействия между Ca2+, HCO3- и вода настолько эффективна, что они делают бикарбонат кальция очень растворимым в этом растворителе; в отличие от CaCO3, в котором электростатические притяжения между Ca2+ и СО32- очень сильны, выпадают в осадок из водного раствора.
Помимо воды, есть молекулы СО2 вокруг, которые реагируют медленно, чтобы обеспечить больше HCO3- (в зависимости от значения pH).
Гипотетическое твердое тело
Пока что размеры и заряды ионов в Са (HCO)3)2, ни присутствие воды, объясните, почему не существует твердого соединения; то есть чистые кристаллы, которые можно охарактеризовать с помощью рентгеновской кристаллографии. Ca (HCO)3)2 это не что иное, как присутствующие в воде ионы, из которых продолжают расти кавернозные образования.
Да ка2+ и HCO3- они могут быть изолированы от воды, избегая следующей химической реакции:
Ca (HCO)3)2(aq) → CaCO3(s) + CO2(г) + Н2O (l)
Затем их можно сгруппировать в белое кристаллическое твердое вещество со стехиометрическими пропорциями 2: 1 (2HCO3/ 1Ca). Там нет никаких исследований о его структуре, но это можно сравнить с NaHCO3 (для бикарбоната магния, Mg (HCO)3)2, не существует как твердое вещество), или с CaCO3.
Стабильность: NaHCO3 против Ca (HCO)3)2
NaHCO3 кристаллизуется в моноклинной системе, и СаСО3 в тригональной (кальцит) и ромбической (арагонитовой) системах. Если Na был заменен+ для ча2+, кристаллическая сеть будет дестабилизирована большей разницей в размерах; то есть Na+ поскольку он меньше, он образует более стабильный кристалл с HCO3- по сравнению с Ca2+.
На самом деле, Ca (HCO)3)2(aq) нуждается в воде, чтобы испариться так, чтобы ее ионы могли быть сгруппированы в кристалле; но кристаллическая решетка этого не достаточно сильна, чтобы сделать это при комнатной температуре. Когда вода нагревается, происходит реакция разложения (уравнение выше).
Быть ионом Na+ в растворе это будет кристалл с HCO3- до его термического разложения.
Причина, почему Ca (HCO)3)2 он не кристаллизуется (теоретически), это происходит из-за разницы ионных радиусов или размеров его ионов, которые не могут образовывать стабильный кристалл до его разложения.
Ca (HCO)3)2 против CaCO3
Если с другой стороны, H был добавлен+ к кристаллическим структурам CaCO3, они бы резко изменили свои физические свойства. Возможно, его точки плавления заметно падают, и даже морфология кристаллов в конечном итоге изменяется.
Стоит ли пытаться синтезировать Са (HCO)3)2 Твердая? Трудности могут превзойти ожидания, и соль с низкой структурной стабильностью может не дать существенных дополнительных преимуществ в любом применении, где другие соли уже используются..
Физико-химические свойства
Химическая формула
Ca (HCO)3)2
Молекулярный вес
162,11 г / моль
Физическое состояние
Он не появляется в твердом состоянии. Он находится в водном растворе и пытается превратить его в твердое вещество путем испарения воды, но не работает, поскольку он превращается в карбонат кальция..
Растворимость в воде
16,1 г / 100 мл при 0 ° С; 16,6 г / 100 мл при 20 ° С и 18,4 г / 100 мл при 100 ° С. Эти значения свидетельствуют о высоком сродстве молекул воды к ионам Са (HCO)3)2, как объяснено в предыдущем разделе. Между тем, только 15 мг CaCO3 они растворяются в литре воды, что отражает их сильное электростатическое взаимодействие.
Потому что Ca (HCO)3)2 он не может образовывать твердое вещество, его растворимость не может быть определена экспериментально. Однако, учитывая условия, созданные СО2 при растворении в воде, окружающей известняк, можно рассчитать массу кальция, растворенного при температуре Т; масса, которая была бы равна концентрации Ca (HCO)3)2.
При разных температурах растворенная масса увеличивается, как показано значениями при 0, 20 и 100 ° С. Итак, согласно этим экспериментам, сколько Ca (HCO) определяется3)2 растворяется в непосредственной близости от CaCO3 в водной среде, газифицированной СО2. Как только СО сбежит2 газообразный, СаСО3 будет выпадать в осадок, но не Ca (HCO3)2.
Точка плавления и кипения
Кристаллическая сеть Ca (HCO)3)2 намного слабее, чем CaCO3. Если его можно получить в твердом состоянии и измерить температуру, при которой он плавится внутри фузиометра, он наверняка получит значение значительно ниже 899ºC. Аналогичным образом, то же самое можно ожидать при определении точки кипения..
Точка сгорания
Это не горючий.
риски
Поскольку это соединение не существует в твердой форме, маловероятно, что оно будет представлять риск манипулирования его водными растворами, поскольку оба Са2+ как HCO3- они не вредны при низких концентрациях; и, следовательно, наибольший риск, который может возникнуть при приеме таких растворов, может быть связан только с употреблением опасной дозы кальция..
Если соединение образовало твердое вещество, хотя оно может физически отличаться от СаСО3, его токсические эффекты не могут выходить за рамки простого дискомфорта и резекции после физического контакта или вдыхания.
приложений
-Растворы бикарбоната кальция долгое время использовались для мытья старых бумаг, особенно произведений искусства или исторически важных документов..
-Использование растворов бикарбоната полезно не только потому, что они нейтрализуют кислоты в бумаге, но и обеспечивают щелочной запас карбоната кальция. Это последнее соединение обеспечивает защиту от будущих повреждений на бумаге.
-Как и другие бикарбонаты, он используется в химических дрожжах и в составах шипучих таблеток или порошков. Кроме того, бикарбонат кальция используется в качестве пищевой добавки (водные растворы этой соли).
-Растворы бикарбоната используются для профилактики остеопороза. Однако вторичные эффекты, такие как гиперкальциемия, метаболический алкалоз и почечная недостаточность, наблюдались в одном случае..
-Бикарбонат кальция вводят, иногда, внутривенно, чтобы исправить депрессивное влияние гипокалиемии на функцию сердца.
-И, наконец, он обеспечивает организм кальцием, который является медиатором сокращения мышц, в то же время он корректирует ацидоз, который может возникнуть в условиях гипокалиемии..
ссылки
- Wikipedia. (2018). Бикарбонат кальция. Взято из: en.wikipedia.org
- Сира Дюбуа. (3 октября 2017 г.) Что такое бикарбонат кальция? Получено с: livestrong.com
- Центр изучения науки. (2018). Карбонатная химия. Получено с: sciencelearn.org.nz
- PubChem. (2018). Бикарбонат кальция. Получено из: pubchem.ncbi.nlm.nih.gov
- Эми Э. Гербрахт и Ирен Брюкль. (1997). Использование растворов бикарбоната кальция и бикарбоната магния в небольших семинарах по консервации: результаты исследования. Получено с: cool.conservation-us.org


