Методы и примеры балансирования химических уравнений
балансировка химических уравнений подразумевает, что все элементы, присутствующие в указанном уравнении, имеют одинаковое количество атомов на каждой стороне. Для достижения этого необходимо использовать методы уравновешивания, чтобы назначить стехиометрические коэффициенты, подходящие для каждого вида, присутствующего в реакции..
Химическое уравнение - это представление посредством символов того, что происходит в ходе химической реакции между двумя или более веществами. Реагенты взаимодействуют друг с другом, и в зависимости от условий реакции в качестве продукта будет получено одно или несколько различных соединений..
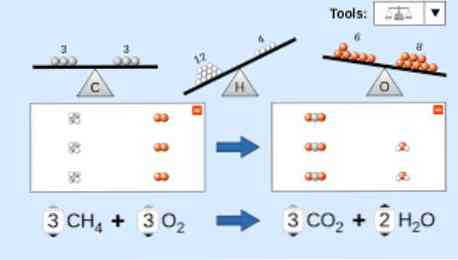
При описании химического уравнения необходимо учитывать следующее: во-первых, вещества с реагентами пишутся в левой части уравнения, за которыми следует однонаправленная стрелка или две противоположные горизонтальные стрелки, в зависимости от типа проводимой реакции. накидка.
индекс
- 1 Методы уравновешивания химических уравнений
- 1.1 Баланс химических уравнений методом проб и ошибок (также называется проверкой или пробой)
- 1.2 Алгебраическое уравновешивание химических уравнений
- 1.3 Скользящее окислительно-восстановительное уравнение (ионно-электронный метод)
- 2 Примеры балансировки химических уравнений
- 2.1 Первый пример
- 2.2 Второй пример
- 2.3 Третий пример
- 3 Ссылки
Методы балансировки химических уравнений
Принимая за основу то, что реагенты и продукты известны, и что их формулы правильно выражены на той стороне, которая им соответствует, мы переходим к уравновешиванию уравнений в соответствии со следующими методами..
Балансировка химических уравнений методом проб и ошибок (также называется проверкой или пробой)
Он основан на стехиометрии реакции и пытается попытаться использовать разные коэффициенты, чтобы сбалансировать уравнение при условии, что выбраны наименьшие возможные целые числа, при которых одинаковое число атомов каждого элемента получается с обеих сторон. реакции.
Коэффициент реагента или продукта - это число, которое предшествует его формуле, и это единственное число, которое может быть изменено при балансировке уравнения, поскольку изменение индексов в формулах изменит идентичность соединения. в вопросе.
Посчитайте и сравните
После определения каждого элемента реакции и размещения его на правильной стороне, мы приступаем к подсчету и сравнению количества атомов каждого элемента, присутствующего в уравнении, и определяем те, которые должны быть сбалансированы.
Затем мы продолжаем балансировку каждого элемента (по одному за раз), помещая целые коэффициенты, предшествующие каждой формуле, содержащей несбалансированные элементы. Обычно сначала уравновешиваются металлические элементы, затем неметаллические элементы и, наконец, атомы кислорода и водорода..
Таким образом, каждый коэффициент умножает все атомы предыдущей формулы; поэтому, уравновешивая элемент, другие могут разбалансировать, но это исправлено, поскольку реакция уравновешена.
Наконец, последним подсчетом подтверждается, что все уравнение правильно сбалансировано, то есть подчиняется закону сохранения материи..
Алгебраическая балансировка химических уравнений
Чтобы использовать этот метод, установлена процедура для обработки коэффициентов химических уравнений как неизвестных системы, которая должна быть решена..
Во-первых, конкретный элемент реакции берется в качестве ссылки, а коэффициенты помещаются в виде букв (a, b, c, d ...), которые представляют неизвестные, в соответствии с существующими атомами этого элемента в каждой молекуле (если вид не содержит этот элемент помещается "0").
После получения этого первого уравнения определяются уравнения для других элементов, присутствующих в реакции; будет столько же уравнений, сколько и элементов в указанной реакции.
Наконец, неизвестные определяются одним из алгебраических методов редукции, выравнивания или замещения, и получаются коэффициенты, которые приводят к правильно сбалансированному уравнению.
Балансирующие окислительно-восстановительные уравнения (ионно-электронный метод)
Сначала общая (несбалансированная) реакция переводится в свою ионную форму. Затем это уравнение делится на две полуреакции: окисление и восстановление, каждая из которых балансируется в зависимости от количества атомов, их типа и зарядов этих.
Например, для реакций, которые происходят в кислой среде, добавляют молекулы H.2Или сбалансировать атомы кислорода и добавить H+ сбалансировать атомы водорода.
Напротив, в щелочной среде добавляется равное количество ионов ОН- по двум сторонам уравнения для каждого иона H+, и где возникают ионы H+ и ОН- они собираются вместе, чтобы сформировать молекулы H2О.
Добавить электроны
Затем вы должны добавить столько электронов, сколько необходимо для уравновешивания зарядов, после уравновешивания вещества в каждой полуреакции..
После прокрутки каждой полуреакции они добавляются и завершаются балансированием окончательного уравнения методом проб и ошибок. В случае различий в количестве электронов в двух полуреакциях, один или оба должны быть умножены на коэффициент, равный этому числу.
Наконец, необходимо подтвердить, что уравнение включает в себя одинаковое количество атомов и атомы одинакового типа, в дополнение к одинаковым зарядам на обеих сторонах глобального уравнения.
Примеры балансирующих химических уравнений
Первый пример
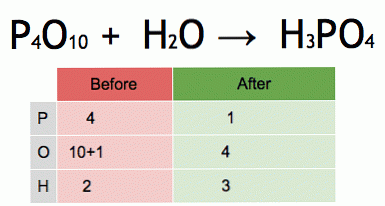
Это анимация сбалансированного химического уравнения. Пентоксид фосфора и вода превращаются в фосфорную кислоту.
P4O10 + 6 H2O → 4 H3PO4 (-177 кДж).
Второй пример
У вас есть реакция сгорания этана (несбалансированная).
С2H6 + О2 → CO2 + H2О
Используя метод проб и ошибок, чтобы уравновесить его, мы видим, что ни один из элементов не имеет одинаковое количество атомов с обеих сторон уравнения. Таким образом, он начинается с баланса углерода, добавляя два в качестве стехиометрического коэффициента, который сопровождает его на стороне продуктов.
С2H6 + О2 → 2CO2 + H2О
Углерод был сбалансирован с обеих сторон, поэтому мы продолжаем балансировать водород, добавляя три к молекуле воды.
С2H6 + О2 → 2CO2 + 3H2О
Наконец, поскольку в правой части уравнения семь атомов кислорода и это последний элемент, который еще предстоит сбалансировать, дробное число 7/2 ставится перед молекулой кислорода (хотя в целом предпочтительны целые коэффициенты).
С2H6 + 7 / 2O2 → 2CO2 + 3H2О
Затем убедитесь, что на каждой стороне уравнения находится одинаковое количество атомов углерода (2), водорода (6) и кислорода (7)..
Третий пример
Окисление железа дихромат-ионами происходит в кислой среде (неуравновешенной и в ее ионной форме).
вера2+ + Cr2О72- → Вера3+ + Cr3+
Используя ионно-электронный метод для его балансировки, он делится на две полуреакции.
Окисление: вера2+ → Вера3+
Сокращение: Cr2О72- → Cr3+
Поскольку атомы железа уже сбалансированы (1: 1), электрон добавляется на сторону продуктов, чтобы сбалансировать заряд.
вера2+ → Вера3+ + и-
Теперь атомы Cr сбалансированы, добавив два к правой части уравнения. Затем, когда реакция происходит в кислой среде, добавляют семь молекул H.2Или на стороне продуктов, чтобы сбалансировать атомы кислорода.
Cr2О72- → 2Cr3+ + 7H2О
Чтобы сбалансировать атомы Н, добавляют четырнадцать ионов Н+ на стороне реагентов и, после выравнивания материала, заряды уравновешиваются путем добавления шести электронов на одной стороне.
Cr2О72- +14H+ + 6e- → 2Cr3+ + 7H2О
Наконец, добавляются обе полуреакции, но поскольку в реакции окисления присутствует только один электрон, все это должно быть умножено на шесть.
6Fe2+ + Cr2О72- +14H+ + 6e- → Вера3+ + 2Пар3+ + 7H2O + 6e-
Наконец, электроны должны быть удалены с обеих сторон глобального ионного уравнения, проверяя, что их заряд и вещество правильно сбалансированы.
ссылки
- Чанг, Р. (2007). Химия. (9-е изд). McGraw-Hill.
- Хейн М. и Арена С. (2010). Основы колледжа химии, альтернатив. Получено из books.google.co.ve
- Tuli, G.D. и Soni, P.L. (2016). Язык химии или химических уравнений. Получено из books.google.co.ve
- Быстрое Издательство (2015). Уравнения химии и ответы (скоростные учебные пособия). Получено из books.google.co.ve


